|
29일 한올바이오파마에 따르면, 자가면역질환 치료제 HL161이 오는 2023년 중국을 시작으로 2024년엔 미국·유럽에서 시판될 전망이다.
‘HL161’는 이뮤노반트(미국·유럽 판권)와 하버바이오메드(중국 판권)에 각각 기술이전 됐다. 이뮤노반트가 3가지 적응증(중증근무력증, 갑상선안병증, 용혈성빈혈) 및 하버바이오메드가 4가지 적응증(중증근무력증, 갑상선안병증, 시신경척수염, 혈소판감소증)으로 개발을 진행하고 있다.
이뮤노반트는 지난해 8월 중증근무력증 임상 2상 성공을 발표했고, 올해 임상 3상 진입을 기대하고 있다. 그리고 올해 2월 중단된 갑상선안병증, 용혈성빈혈 2상 임상 재개도 앞두고 있다.
자가면역 질환은 세균·바이러스 등 외부 침입자로부터 내 몸을 방어해야 할 항체가 반대로 자기 자신의 몸(세포를 파괴)을 공격하는 병이다. 자기항체가 몸의 어떤 부위를 공격하느냐에 따라 증세가 다양하게 나타나 100여 가지 질병으로 구분된다.
HL161,최대 15개 적응증으로 수십조원 시장 타깃
HL161의 미래가치는 무궁무진하다는 평가다. 한올바이오파마 관계자는 “중증 근무력증, 갑상성 안병증 등 질환별로 약가와 치료제 경쟁상황을 고려하면 적게는 수천억에서 많게는 3조원까지 평가된다”면서 “HL161 작용기전을 고려하면 적용 가능한 적응증이 최대 15개에 이를 것으로 보고 있다. HL161이 적응증을 10~15개 넓히면 수십조원 시장 가치를 지닐 것”이라고 내다봤다. 이뮤노반트와 하버바이오메드는 HL161을 후보물질 단계에서 구매했기 때문에 원하는 대로 적응증을 개발할 수 있다.
실제 미국에서도 HL161을 5조원 이상으로 보고 있다. 다국적제약사는 로이반트는 지난 2017년 12월 HL161을 사들인 뒤, 이뮤노반트라는 이듬해 별도 법인을 설립한 뒤, HL161 개발을 진행하고 있다. 한올바이오파마는 로이반트는 전략적으로 질환별로 자회사를 만들어서 개발을 진행하는 회사라고 설명했다. 다시 말해, 이뮤노반트의 시가총액이 곧 HL161 시장가치인 셈이다. 이모뉴반트는 HL161 임상중단 직전인 지난 1월 시가총액이 5조원에 달했다.
|
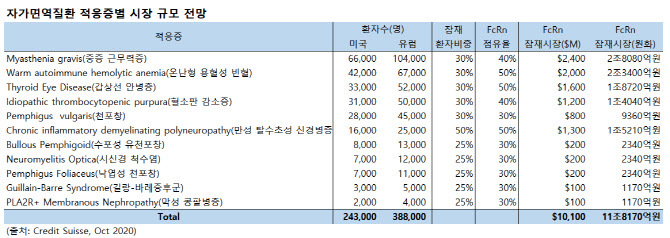
크레딧스위스는 지난해 10월 보고서를 통해 자가면역 질환의 미국·유럽 시장 규모를 11조8170억원으로 추산했다.
구체적으로 중증 근무력증 2조8080억원, 온난형 용혈성 빈혈 2조3400억원, 갑산성 안병증 1조8720억원, 혈소판 감소증 1조4040억원, 천포창 9360억원, 만성 탈수초성 신경병증 1조5210억원, 수포성 유천포창 2340억원, 시신경 척수염 2340억원, 낙엽성 천포창 2340억원, 길랑-바레증후군 1170억원, 막성 콩판병증 1170억원 등 11개 적응증의 시장 규모를 합산한 수치다. 유럽과 북미엔 전체 인구의 5%가 자가면역질환을 가지고 있는 것으로 알려졌다.
“콜레스트롤 문제없어...연말 임상재개”...2023년 中에서 시판
올해 2월 이모뉴반트의 임상 2상 중단에 따른 시장 불안에 대해선 선을 그었다. 한올바이오파마 관계자는 “미국에서 실시 중이던 용혈성빈혈 2b상에서 일부 환자에서 콜레스테롤 수치가 예상보다 높게 나와서 임상 중단됐다”면서 “이후 이모뉴반트는 HL161 관련 치료제 임상을 전면 중지하고, 4개월간 해당 사안을 살펴본 뒤 지난 6월 분석결과를 발표했다.
이모뉴반트는 HL161의 콜레스테롤 수치는 통제 가능하고 예상 가능 범위에서의 변화였다고 발표했다”고 전했다. 이모뉴반트는 중단했던 HL161 임상을 올해 말부터 재개할 예정이다.
당장 2023년부터 상업화가 이뤄질 전망이다. 한올바이오파마 관계자는 “중국에서 내년 임상 3상이 마무리돼 빠르면 2023년 상업화가 가능할 것 같다”면서 “미국·유럽에선 2024년경이면 가능할 것 같다”고 말했다. 이어 “HL161 기술수출 계약은 한올바이오파마가 임상단계별로 마일스톤을 받게 돼 있다”면서 “또 상업화 이후엔 10% 중반대의 매출액 기반 로열티를 받는 구조”라고 설명했다.


![월드컵까지 따냈다...스포츠산업 '생태계 파괴자' 된 빈살만[글로벌스트롱맨]](https://image.edaily.co.kr/images/Photo/files/NP/S/2023/11/PS23110500115t.jpg)

![[포토] 폭염 속 휴식취하는 건설 근로자](https://image.edaily.co.kr/images/Photo/files/NP/S/2023/08/PS23080100718t.jpg)








![[포토]이주호 사회부총리, 40개 의대 총장 간담회…"학생·교수 복귀 총력"](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042400781t.jpg)
![[포토] '인구감소 시대의 부동산 정책 및 시장 영향'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042400618t.jpg)
![[포토]치솟은 과일·채소값에 유가 꿈틀까지](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042400598t.jpg)
![[포토]소리에 집중할 수 있는 와이덱스 스마트RIC](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042400544t.jpg)

![[포토]책의날 맞아 시민들에게 책 나눠주는 유인촌 문체부 장관](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042300692t.jpg)
![[포토] 안병우 축산경제 대표, 청정축산 환경대상 시상식](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042300549t.jpg)
![[포토] 하나로마트 창립 29주년 70% 세일](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042300533t.jpg)
![[포토]세계 책의 날 맞아 문체부, 국무회의에서 국무위원들에게 책 선물](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042300428t.jpg)
![관람객 홀리는 전기차 미래기술 다 모였다…EVS37 가보니[르포]](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042401076.gif)
![[포토] 임성재 '올림픽 나갈 수 있다면 최선을 다해 메달을 따겠습니다'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042400119t.jpg)