|
FDA가 긴급사용승인을 내리는 경우는 ‘질병의 상태를 진단·예방 또는 치료하기 위한 대안(의약품 등)이 없을 경우’에 해당한다. 미국은 지난해부터 코로나 백신 긴급사용승인을 내줬으며, 모더나와 화이자, 얀센 등 총 3가지 품목이 유통되고 있다. 이미 자국 국민에 필요한 물량을 충분히 확보한 만큼 굳이 긴급사용승인을 추가로 할 필요가 없다고 판단한 것이다.
화이자와 모더나는 각각 지난 5월과 이달 초 FDA에 BLA를 신청한 상태다. FDA로부터 우선심사를 승인받을 경우 전문의약품 허가신청자비용부담법(PDUFA)에 따라 6개월 이내로 최종 품목허가 여부가 결정된다.
한국 정부 역시 3분기에 도입될 가능성이 없다고 보고 있다. 손영래 중앙사고수습본부 사회전략반장은 전일 “3분기 주력 접종 백신은 화이자와 모더나로 바뀌는 구도로 가고 있다”며 “노바백스의 허가가 차질을 빚는다고 해도 3분기 8000만회분이 들어올 예정이다”고 밝혔다.
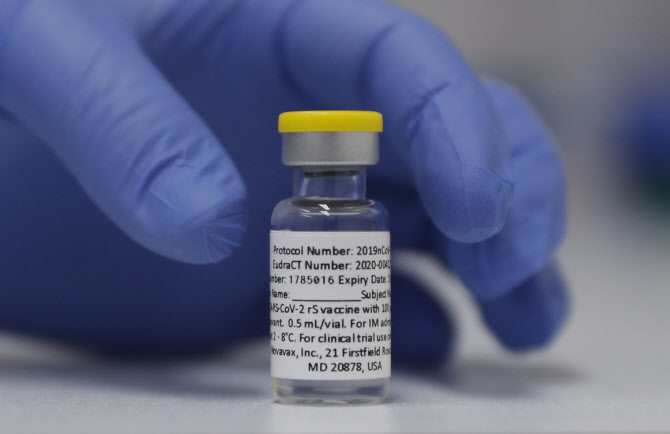
SK바이오사이언스(302440)는 노바백스 허가와 직접적으로 연관된 국내 기업이다. 노바백스 위탁개발생산(CDMO)과 라이선스인 물량이 집중적으로 생산될 하반기 실적에 대한 기대감이 높았다. 올해 1분기 아스트라제네카 백신 생산을 통해 매출 1000억원, 영업이익 537억원을 돌파하며 분기 최대 성적을 냈다. 하지만 노바백스 허가지연 이슈로 인해 시장 예상 연매출 1조원 달성에 타격이 불가피하다는 전망이 나온다. 현재 시험생산(PPQ)을 하면서 대기 중이다.
CMO업계 관계자는 “CMO 계약은 리스 형태처럼 공장 일부를 빌리는 형식과 비슷하다. SK바이오사이언스와 노바백스의 계약 형태에 따라 손해 크기가 달라질 거다. CMO 특성상 손해가 난다고 해도 적자까진 아니고, 당초 예상했던 것보다 매출이 안 나오는 정도로 예상한다”고 말했다. 이어 “SK바이오사이언스가 어떤 계약형태인지 비공개이지만, 결국 CMO는 대량 생산을 해야만 돈을 버는 구조다. 시험생산은 소량이다”고 했다.
SK바이오사이언스 관계자는 “계약형태는 비공개 사항이다. 다만 꼭 FDA가 아니더라도 영국이나 유럽 등 다른 선진국에서 먼저 허가가 나오면 곧바로 전 세계 공급이 가능할 거라고 본다”며 “mRNA 백신보다 유통과 보관도 훨씬 뛰어나며, 수요가 충분하다”고 말했다.

![월드컵까지 따냈다...스포츠산업 '생태계 파괴자' 된 빈살만[글로벌스트롱맨]](https://image.edaily.co.kr/images/Photo/files/NP/S/2023/11/PS23110500115t.jpg)

![[포토] 폭염 속 휴식취하는 건설 근로자](https://image.edaily.co.kr/images/Photo/files/NP/S/2023/08/PS23080100718t.jpg)








![[포토]유정복 인천시장 축사](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24041800929t.jpg)
![[포토] 고군택 '신들린 샷으로 초대 챔피언을 노린다'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24041800207t.jpg)
![[포토]제60회 한국보도사진전 찾은 유인촌-오세훈](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24041800649t.jpg)
![[포토]ERT 도시숲 나무심기 행사](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24041800632t.jpg)
![[포토] 의료진에게 감사 박수](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24041800624t.jpg)
![[포토]'대화하는 윤상현-김용태'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24041800609t.jpg)
![[포토]오늘은 장애인의 날](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24041800554t.jpg)
![[포토]'AMG SL 63 4MATIC+ 마누팍투어' 120대 한정 럭셔리 로드스터](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24041800353t.jpg)
![[르포]한국타이어 '기술력' 자신감 원천…테크노돔·플렉스·링 가보니](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24041900007t.jpg)