|
[이데일리 김대웅 기자] 에이치엘비(028300)는 미국 자회사 LSK BioPharma(LSKB)에서 개발중인 리보세라닙과 일본 타이호약품공업의 론서프 병용요법으로 전이성 대장암에 대한 임상 1b/2상 시험을 미국 FDA로부터 최종 승인 받았다고 26일 밝혔다.
임상 1b 시험은 리보세라닙과 론서프 병용요법의 최적용량 결정, 임상 2상 시험은 약 100명의 환자를 대상으로 리보세라닙+론서프 병용요법군, 리보세라닙 단독요법군 및 론서프 단독요법군으로 나뉘어 진행된다.
회사 관계자는 “임상 1b/2상 시험을 빠른 시간 내에 마무리하고 약효가 검증되면 글로벌 임상 3상으로 확장할 계획“이라고 밝혔다.
리보세라닙(중국, 아파티닙)은 2018년 국제 과학기술논문인용색인(SCI)급 학술지인 ‘클리니컬 콜로렉탈 캔서(Clinical Colorectal Cancer)’와 네이처 자매지인 ‘사이언티픽 리포트(Scientific Report)’에 대장암 임상 결과가 각각 발표된 바 있다.
중국 쑤저우의과대학과 난징의과대학이 공동으로 대장암 환자 36명에게 지난 2015~2017년 리보세라닙을 투여한 뒤 완전관해 1명(2.8%), 부분관해 3명(8.3%), 안정병변 24명(66.7%), 진행성병변 8명(22.2%)의 예후를 보였다.
연구결과를 보면 질병통제율(DCR)이 77.8%, 무진행생존 중간값(mPFS)는 4.8개월, 전체 생존 중간값(mOS)는 10.1개월로 나타났다. 이는 현재 허가 받은 대장암 3차 치료제 스타바가(Regorafenib)의 2건의 임상결과 전체 생존 중간값이 6.4개월, 8.8개월로 발표된 것보다 뛰어나다.
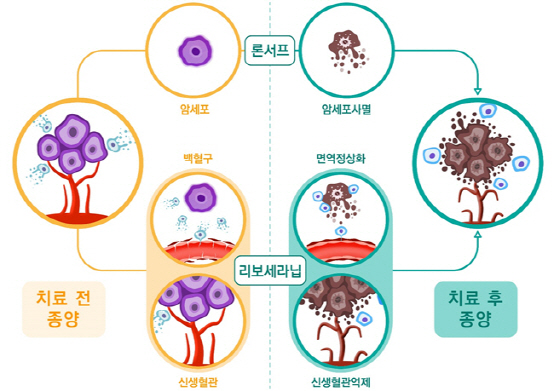
리보세라닙+론서프 병용요법에서 론서프는 암세포에 직접적으로 작용하여 사멸을 유도하고, 리보세라닙은 종양 증식에 필요한 신생혈관의 생성을 억제시키고 비정상적인 암 혈관구조를 정상화하여 면역세포를 활성화시킨다. 론서프와 리보세라닙은 부작용이 겹치지 않고 모두 경구용 약품으로 복용이 용이하다는 장점이 있어 최적의 병용 조합으로 기대되고 있다고 회사 측은 설명했다.


![월드컵까지 따냈다...스포츠산업 '생태계 파괴자' 된 빈살만[글로벌스트롱맨]](https://image.edaily.co.kr/images/Photo/files/NP/S/2023/11/PS23110500115t.jpg)

![[포토] 폭염 속 휴식취하는 건설 근로자](https://image.edaily.co.kr/images/Photo/files/NP/S/2023/08/PS23080100718t.jpg)






![[포토]김희지 '핀 주변을 살핀다'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042500654t.jpg)
![[포토]2024 이데일리 금융투자대상 금융투자 부분 수상자들](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042501046t.jpg)
![[포토]'서울외신기자클럽 기자간담회 참석하는 이준석 대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042500759t.jpg)
![[포토]쾌적한 비행을 위해 봄맞이 세척](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042500578t.jpg)
![[포토] '법의 날' 축사하는 이종석 헌법재판소장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042500502t.jpg)
![[포토]'기자회견 기다리는 황운하'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042500358t.jpg)
![[포토]정책조정회의, '모두발언하는 홍익표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042500272t.jpg)

![[포토]이주호 사회부총리, 40개 의대 총장 간담회…"학생·교수 복귀 총력"](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042400781t.jpg)
![[포토] '인구감소 시대의 부동산 정책 및 시장 영향'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042400618t.jpg)
![[포토] 임성재 '임성재의 플레이는 오늘부터'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042600115t.jpg)
