|
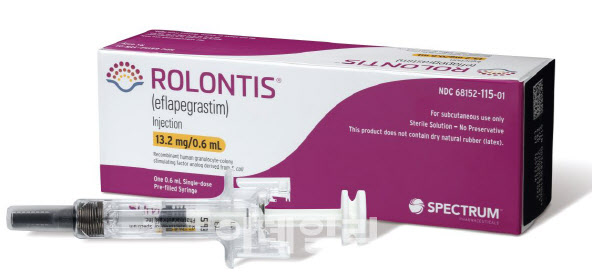
식품의약품안전처는 ‘롤론티스프리필드시린지주(성분명 에플라페그라스팀, 이하 롤론티스)’를 국내 33번째 개발 신약으로 허가했다고 18일 밝혔다.
이 약은 항암화학요법을 받는 암 환자에게 발생하는 호중구 감소증의 치료나 예방 용도로 투여할 수 있다. 호중구 감소증은 백혈구 중 40~70%를 차지하는 호중구가 비정상적으로 감소해 감염에 취약해지는 증상이다.
롤론티스는 호중구 감소증이 발생한 초기 유방암 환자 643명을 대상으로 진행한 두번의 임상에서 총 네 번의 치료 사이클 동안 경쟁 약물 대비 DSN(중증 호중구감소증 발현기간)의 비열등성 및 우수한 상대적 위험도 감소율 등이 입증됐다.
한미약품은 롤론티스를 이전해간 미국의 파트너 제약사 스펙트럼과 함께 롤론티스의 미국 시판허가 절차도 진행중이다.
앞서 코로나19 확산으로 잠정 연기됐던 절차가 다시 진행되는 것으로 멈춰 있던 롤론티스의 FDA 허가 절차가 돌아가기 시작한 셈이다.
한미약품은 호중구 감소증 치료제의 국내 시장 규모는 800억원대, 글로벌 시장은 3조원대로 추정했다.
한미약품 권세창 사장은 “롤론티스는 한미약품의 독자 플랫폼 기술인 랩스커버리가 적용된 바이오신약 중 처음으로 허가된 의미있는 제품”이라며 “한국에서의 세계 첫 허가를 시작으로 미국 등에서도 허가를 획득해 글로벌 시장에서 성공하는 한국의 첫번째 바이오신약이 될 수 있도록 최선을 다하겠다”고 말했다.


![월드컵까지 따냈다...스포츠산업 '생태계 파괴자' 된 빈살만[글로벌스트롱맨]](https://image.edaily.co.kr/images/Photo/files/NP/S/2023/11/PS23110500115t.jpg)

![[포토] 폭염 속 휴식취하는 건설 근로자](https://image.edaily.co.kr/images/Photo/files/NP/S/2023/08/PS23080100718t.jpg)






![[포토]이수진 '장타로 시작합니다'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/06/PS24060100634t.jpg)
![[포토] 김민규 '매치킹 원하는 한국오픈 챔프'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/06/PS24060100539t.jpg)
![[포토]장민규 '온그린을 기대한다'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/05/PS24053100522t.jpg)
![[포토] 고군택 '일본에서부터 좋은 샷감을 이어간다'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/05/PS24053100483t.jpg)
![[포토]민희진 어도어 대표 주총 관련 기자회견](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/05/PS24053100853t.jpg)
![[포토] 안전한국훈련 참가한 조성명 강남구청장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/05/PS24053100678t.jpg)
![[포토] H&M 피팅룸](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/05/PS24053100293t.jpg)
![[포토]검찰 송치되는 김호중 소속사 본부장](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/05/PS24053100059t.jpg)
![[포토] 허인회 '2승을 달리다'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/05/PS24053000205t.jpg)
![[포토] 이마트, 영업시간 변경](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/05/PS24053000858t.jpg)
![[포토]이수진 '첫 타구는 문제없지'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/06/PS24060100636t.jpg)