뉴스 검색결과 577건
- 국민 57% '먹거리 안전 상식' 잘못 알고 있다
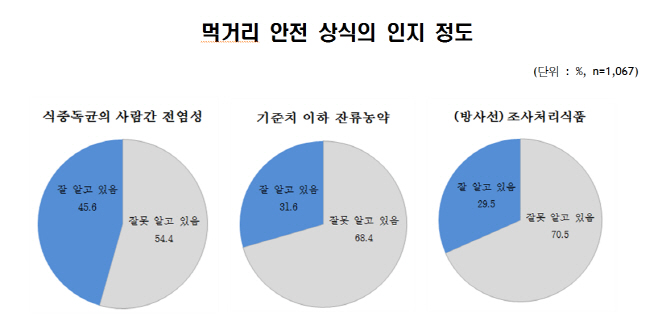
- [이데일리 이연호 기자] 우리 국민 대다수가 먹거리 안전에 대해 관심을 갖고 있는데 반해 100명 중 57명 꼴로 먹거리 안전 상식을 잘못 알고 있는 것으로 조사됐다. 먹거리 안전에 대한 대국민 정보전달 및 소통방안에 대한 개선책 마련이 필요하다는 지적이다.그래픽=한국식품연구원.지난해 8월 출범한 ‘먹거리 안전 선도기술 융합 클러스터’(주관기관 한국식품연구원)가 ‘국민생활과학자문단 먹거리안전 분과위원회’와 공동으로 대국민 설문조사를 실시한 결과 응답자의 93.8%가 ‘먹거리 안전에 관심이 있다’고 했으나 먹거리 안전 상식과 관련된 14개 질문에 대해서는 57%의 오답률을 보였다.이번 설문조사는 먹거리 안전에 대한 국민의 인식과 경험 등을 다각적으로 파악하기 위해 한국갤럽에 의뢰해 온라인으로만 19∼60세 남녀 1067명을 대상으로 실시했으며 복수 응답을 허용했다.먹거리 안전 선도기술 융합 클러스터는 국가과학기술연구회가 지원하고 한국식품연구원, 한국과학기술연구원, 한국원자력연구원 등 정부출연연구기관과 학계, 기업계 등으로 구성된 먹거리 안전 전문가 협의체로 국민생활에서 우선적으로 해결해야 하는 먹거리 안전문제들을 찾아보기 위해 국민의 인식조사를 진행했다.먹거리 안전 상식의 인지 정도에 대한 조사 결과 대표적으로 ‘식중독균은 사람 간에 전염될 수 있는가’라는 질문에 전체 응답자의 54.4%, ‘잔류농약은 기준치 이하라도 위험한가’라는 질문에는 68.4%, ‘(방사선) 조사처리식품은 방사성 물질이 남아 있어 위험한가’라는 질문에는 70.5%가 잘못 알고 있는 것으로 나타났다.먹거리 안전과 관련된 여러 가지 요인 중 ‘식중독 유발 미생물, 중금속, 독소류, 방사성 물질, 환경호르몬’에 대해 전체 응답자의 90% 이상이 위해(危害)하다고 답했다. ‘기생충, 잔류농약, 잔류 항생제, (방사선) 조사처리 식품, 위변조 식품, 식품 이물’에 대해서는 전체 응답자의 80% 이상이, ‘유전자 변형식품(GMO), 식품첨가물’에 대해서는 70% 이상이 위해하다고 답변했다.먹거리 안전에 대한 정보는 주로 TV·라디오(72.6%), 인터넷(59.6%)에서 얻는다고 답했다.정보 전달 주체에 대해서 ‘언론의 식품 안전 보도’는 전체 응답자의 51.4%, ‘인터넷 상의 식품 안전 정보’는 36.8%, ‘먹거리 안전 전문가의 의견’은 64.9%가 신뢰한다고 답했다. 이는 상대적 신뢰도가 낮은 인터넷을 통해 오히려 많은 정보를 얻고 있음을 보여준다.먹거리 안전 관련 활동 참여에 대해서는 식품안전뉴스 구독(69.0%), SNS·인터넷을 통한 의견 제시(68.3%)에 높은 의향을 보인데 반해 비정기적 학술정보 공개 모임(34.7%), 정기적 정보 공유 모임(41.2%)에 상대적으로 낮은 의향을 보였다. 국민생활과학기술 포럼, 식품의약품안전 열린 포럼 등 국민 참여 프로그램에 대해서는 70% 이상의 응답자가 ‘들어본 적이 없다’고 답해 오프라인 뿐 아니라 온라인을 활용해 좀 더 실효성 있고 지속적인 소통방법을 찾는 노력이 필요할 것으로 분석됐다.과학기술 전문가와 일반인의 소통에 대해서는 전체 응답자의 94.8%가 ‘소통이 잘 안됨’ 또는 ‘문제 발생 시 잘 되나 평소에는 잘 안됨’이라고 응답했다. 그 이유에 대해서는 ‘과학기술 전문가의 정보 공개 내용이 미흡해서’(52.0%), ‘일반인은 전문가와 소통을 원하나 소통할 방법을 몰라서’(49.4%) 순으로 답했다.먹거리 안전을 확보하기 위해 과학기술 전문가들에게 바라는 일에 대해서는 먹거리 안전 실태 조사(45.2%), 먹거리 안전사고 발생 시 원인 규명(34.9%), 위해 인자의 잠재적 위험 분석(33.4%) 순으로 답했다.