뉴스 검색결과 10,000건 이상

- [임상 업데이트] 셀트리온, CT-P42 장기 치료 유효성 입증
- [이데일리 김진수 기자] 한 주(5월 6일~5월 10일) 국내 제약·바이오 업계에서 주목받은 임상이다.셀트리온. (사진=셀트리온)◇셀트리온, CT-P42 장기 치료 유효성 입증셀트리온이 ‘시력 및 안과학회’(이하 ARVO)에서 안과질환 치료제 아일리아(성분명 애플리버셉트) 바이오시밀러 ‘CT-P42’의 글로벌 임상 3상 52주 결과를 발표했다고 9일 밝혔다.ARVO는 안과 관련 최신 지견과 혁신적인 치료법을 공유하는 세계 최대 규모의 안과 국제 학회다. 올해는 이달 5일부터 9일까지 5일간 미국 시애틀에서 개최됐다.셀트리온은 학술대회 넷째 날 열린 발표 세션에 참가해 당뇨병성 황반부종(DME) 환자 348명을 대상으로 진행한 글로벌 3상의 52주 결과를 구두 발표했다. 지난해 셀트리온이 공개한 CT-P42의 임상 3상 24주 결과에서 추가 관찰된 장기 임상 결과를 공개하는 것은 이번이 처음이다.임상에서는 DME 환자를 CT-P42 투여군과 오리지널 의약품 투여군으로 무작위 배정해, CT-P42의 오리지널 의약품 대비 유효성 및 안전성 등을 52주간 평가했다. 임상 결과에 따르면, 두 투여군 모두 최대 교정시력(BCVA) 평균 변화량이 베이스라인 대비 16주차까지 점차 증가 후 52주차까지 안정적으로 유지돼 CT-P42의 장기 치료적 유효성을 입증했다. 그 외 다른 2차 유효성 평가변수와 안전성에서도 유사성을 나타냈다.이번 연구 결과를 통해 장기 유효성 및 안전성을 확인한 셀트리온은 CT-P42가 글로벌 주요 국가에서 허가를 받으면 시장에 빠르게 침투할 것으로 기대하고 있다. 셀트리온은 지난해 미국, 한국, 캐나다, 유럽 등 글로벌 주요 시장에 CT-P42의 허가 신청을 완료한 바 있다.셀트리온 관계자는 “CT-P42의 장기 데이터가 축적되면서 오리지널 대비 장기 유효성 및 안전성을 확인했다”며 “CT-P42를 비롯해 허가 신청을 완료한 바이오시밀러의 원활한 승인을 위해 남은 절차도 차질 없이 진행하고 환자들에게 조속히 공급할 수 있도록 최선을 다할 것”이라고 말했다.◇신라젠, ‘BAL0891’ 급성 골수성 백혈병 임상 추진신라젠은 삼중음성유방암과 위암을 대상으로 임상을 진행 중인 항암제 BAL0891을 급성 골수성 백혈병(AML) 대상으로 임상을 확대한다고 밝혔다. 이로써 BAL0891은 기존 고형암뿐만 아니라 혈액암을 대상으로 적응증 확장을 추진한다.신라젠이 지난 2022년 스위스 바실리아사로부터 도입한 BAL0891은 유사분열 체크포인트 억제제(MCI) 계열 항암제로 2023년부터 미국과 한국에서 임상을 진행하고 있다. BAL0891은 TTK(threonine tyrosine kinase)와 PLK1(polo-like kinase 1)을 동시에 억제하는 기전을 가지고 있으며, 이 두 인산화 효소를 동시에 억제하는 기전은 BAL0891이 계열 내 최초(First-in-Class)다.이번에 신라젠이 임상을 추진하는 급성 골수성 백혈병은 골수의 조혈모세포로부터 혈액세포가 생성되는 초기 단계에서 발생하는 혈액암으로, 다양한 종류의 성인 백혈병 중 가장 흔한 형태이며 전체 백혈병 환자의 절반 이상을 차지한다.대부분의 경우 외부 원인 없이 세포 내에서 무작위로 발생하며, 질환 진행 속도가 매우 빨라 진단 후 치료받지 않으면 1년 이내에 90%가 사망할 정도로 매우 치명적인 질환이다. 재발률은 무려 50% 이상으로 알려졌다.글로벌 시장조사기관 글로벌 데이터(Global Data)에 따르면 급성 골수성 백혈병 치료제 시장은 연평균(CAGR) 13.65% 성장해 2029년에는 51.3억 달러(약 7조원)에 이를 것으로 전망한다.신라젠은 임상 확대에 대해 “급성 골수성 백혈병에 대한 BAL0891의 우수 전임상 데이터는 이미 바실리아 시절부터 보유하고 있었다”며 “향후 우수한 급성 골수성 백혈병 치료제 옵션으로 개발되길 기대한다”라고 밝혔다.◇티움바이오, ‘메리골릭스’ 자궁내막증 유럽 임상 2a상 성공희귀난치성질환 치료제 연구개발 전문기업 티움바이오는 메리골릭스의 자궁내막증 유럽 임상 2a상 톱라인(Topline) 결과를 7일 발표했다.메리골릭스는 자궁내막증과 자궁근종 등의 치료를 목적으로 하는 경구용 성선자극호르몬 길항제(oral GnRH antagonist)로, 기존 치료제인 성선자극호르몬 작용제(GnRH agonist) 대비 경구 복용 편의성 및 안전성을 개선한 기전의 치료제다.임상시험수탁기관(CRO) 아이큐비아(IQVIA)로부터 수령한 톱라인 데이터 결과, 메리골릭스의 자궁내막증 유럽 임상 2a상 주평가지표(primary endpoint)인 ‘월경통(dysmenorrhea) 감소’ 평가 결과 모든 용량(120㎎/240㎎/320㎎)에서 위약 대비 통계적 유의성을 달성했다. (120㎎ 그룹 p=0.044, 240㎎ 그룹 p=0.001, 320㎎ 그룹 p<0.001).이번 임상시험은 이탈리아, 폴란드, 체코 등 유럽 5개국에서 중등증(moderate) 및 중증(severe) 자궁내막증 환자 대상으로 무작위·이중맹검·위약대조 임상으로 실시됐다. 12주간 메리골릭스 120㎎, 240㎎, 320㎎ 또는 위약을 하루 한 번(QD) 경구 투약해 메리골릭스의 효능 및 안전성을 평가하는 목적이었다.임상시험의 주평가지표는 월경통의 감소 정도를 기저치(baseline)대비 투약 12주차 평가하는 것이었고, 평가는 NRS(Numeric Rating Scale, 0~10) 척도를 사용했다. 그 결과 총 83명의 분석그룹(FAS, Full Analysis Set) 중 120㎎ 투약그룹의 통증은 평균 -4.3점, 240㎎ 투약그룹은 -5.4점, 320㎎ 투약그룹은 -6.2점이 기저치 대비 감소했다. 위약그룹의 통증이 평균 -2.7점 감소한 것과 비교했을 때 모든 투약그룹에서 통계적 유의성을 충족하였음을 확인했다(p<0.05).메리골릭스는 이번 임상에서 치료제와 관련된 심각한 이상반응(Serious TEAE related to study medication)을 보인 환자 없이 안전한 안전성 결과를 확보했다.김훈택 티움바이오 대표는 “임상 2a상에서 그룹별로 환자가 20명 내외의 작은 사이즈의 임상시험에도 불구하고 모든 용량에서 위약 대비 통계적으로 유의미한 약효 및 안전성 결과를 확보한 것에 대해 기쁘다”며 “메리골릭스 투약 후 월경통(dysmenorrhea) 감소율 및 안전성 데이터에서 기존 출시된 자궁내막증 치료제와 비교해 괄목할 만한 임상 효과를 확인했다”고 말했다.◇JW중외제약, 美학회서 탈모치료제 ‘JW0061’ 전임상 결과 발표JW중외제약은 이달 15일부터 18일까지 미국 텍사스주 달라스에서 열리는 미국 피부연구학회(Society of Investigative Dermatology)에서 Wnt 표적 탈모치료제 ‘JW0061’의 전임상결과를 포스터 발표한다고 7일 밝혔다.JW0061은 Wnt 신호전달경로를 활성화해 모낭 증식과 모발 재생을 촉진시키는 혁신신약(First-in-Class) 후보물질이다. 이 물질은 JW중외제약의 AI(인공지능) 기반 데이터 사이언스 플랫폼 ‘주얼리’(JWELRY)를 통해 발굴됐다.Wnt 신호전달경로는 배아 발생과 신체 성장 과정에서 피부 발달과 모낭 형성에 중요한 역할을 하며, 피부 줄기세포의 모낭 분화를 촉진한다. 특히, 모근 끝에 위치해 모발의 성장과 유지를 조절하는 모유두(Dermal Papilla) 세포 증식에도 관여한다.JW0061은 모유두 세포에 있는 GFRA1 단백질에 직접 결합해 Wnt 신호전달경로를 활성화한다. JW중외제약은 ‘Wnt 2022’ 학회에서 발모 작용기전을 규명한 최초의 저분자 약물 사례로 JW0061를 공개해 주목을 받은 바 있다.JW중외제약은 이번 미국 피부연구학회에서 인간 피부 오가노이드(장기 유사체)를 포함한 다양한 모델의 효능 평가 결과를 공개한다. 오가노이드는 환자들의 장기 조직뿐만 아니라 구조·기능적 특이성을 재현한다. 동물실험을 대체할 수 있으며, 직접 임상시험을 하지 않고도 결과를 예측할 수 있는 차세대 신약 개발 기술이다.JW중외제약은 전임상 연구결과를 바탕으로 연내 임상 1상에 착수할 계획이다. 현재 해외기관에서 GLP(Good Laboratory Practice, 비임상시험규정)에 따른 독성평가를 마쳤으며, 임상용 약물을 생산하고 있다.JW중외제약 관계자는 “다양한 비임상 시험에서 JW0061의 우수한 모발 성장과 모낭 신생성 효과가 확인되고 있다”며 “이번 학회 발표를 통해 기존 탈모치료체를 보완, 대체하는 혁신적인 치료 옵션으로서의 JW0061 개발 가능성을 국제적으로 공고히 할 계획”이라고 말했다.

- [VC’s Pick]"신개념 의료에 미래가"…레디큐어·드림팩 투자 유치
- [이데일리 마켓in 김연지 기자] 이번 주(5월 7일~10일)에는 게임과 바이오 등 다양한 분야의 스타트업이 벤처캐피털(VC) 및 액셀러레이터(AC)의 투자를 유치했다. 특히 신개념 의료기기 및 관련 솔루션사에 대한 투자가 두드러졌다.(사진=이미지투데이)◇ 치매 전용 디지털엑스선 시스템 ‘레디큐어’치매 전용 디지털 엑스선 치료 시스템을 개발하는 스타트업 레디큐어는 퓨처플레이로부터 프리A시리즈 투자를 유치했다. 투자 규모는 비공개다.레디큐어는 치매 전용 디지털 엑스선 치료 시스템 활용을 제공하는 플랫폼 기업으로2021년 설립되었다.현재 저선량 엑스선의 다중기전 및 치료 효과에 대한 초기 탐색 임상 연구 결과를 바탕으로 치매 전용 의료기기 헬락슨(HeLaXON)을 개발 중이다. 퓨처플레이는 레디큐어의 연구성과를 높이 평가했다. 레디큐어가 알츠하이머형 치매 환자를 대상으로 한 임상을 통해 인지능력 감소 완화 등의 유의미한 결과를 냈다는 설명이다. 특히 최근 개발되는 치매 신약의 질병 완화 속도가 27% 였다면 레디큐어의 헬락슨은 최대 80%까지 완화가 가능하다는 점도 높이 평가했다. 레디큐어는 이번 투자 유치를 계기로 새로운 치매 치료 시스템 개발에 박차를 가한다는 계획이다.◇ 고형암 복강파종 의료기기 개발 ‘드림팩’고형암 복강파종의 치료를 위한 신복강항암화학요법인 ‘가압복강에어로졸항암화학요법(PIPAC)’ 관련 정밀의료기기를 개발 중인 드림팩이 서울대기술지주로부터 후속 투자를 받았다. 투자금액은 비공개다. 드림팩은 복강 내 고압에어로졸 항암 화학요법을 통한 고형암 복막암종증 치료와 완화의료요법, 말기암 환자의 생존율 향상 등을 위한 기술개발 및 의료서비스를 공급하고 있다. 투자사는 드림팩의 기술력을 높이 평가했다. PIPAC은 2010년부터 유럽을 중심으로 시행되고 있는 완화복강항암화학요법으로 더이상 마땅한 치료 방법이 없는 복강파종 고형암 환자들을 대상으로 비용-효과적인 치료 반응 (20-80%)을 유도하고, 섭식과 신체활동 등의 삶의 질을 향상시키는 임상적 근거가 확보되었다. 그러나 국내의 경우 관련 의료기기의 복잡한 인증과 허가, 행위 수가에 대한 관련 진입장벽으로 도입이 되지 않았다. 이에 드림팩은 자체 의공학 기술로 개발한 PIPAC과 약물전달력을 향상시킨 회전가압복강에어로졸항암화학요법(RIPAC) 의료기기를 개발해 신의료기술 및 혁신의료기기로의 단계 평가를 준비 중이다. ◇ 서브컬처 장르 게임 ‘지피유엔’서브컬처 장르 전문 게임 개발사 지피유엔(GPUN)은 카카오벤처스, 코나벤처파트너스로부터 17억 원 규모 시드 투자를 유치했다.지피유엔이 개발 중인 ‘프로젝트 테라리움’은 외계생명체에 침략당한 인류가 지하로 피신, 지구 수복을 위해 싸워나가는 과정을 그린 서브컬처 메카닉 슈팅 게임이다.투자사들은 서브컬처 게임 장르의 성장성과 지피유엔의 역량을 높이 평가했다. 우선 전 세계 모바일 게임 30위권 내 서브컬처 게임 매출 비중은 2020년부터 2023년까지 연평균성장률(CAGR)은 40%를 상회한다. 같은 기간 전체 모바일 게임 중 서브컬처 매출 비중은 18%까지 성장했다. 상대적으로 지역적 영향이 적고, 캐릭터 매력도에 따라 강력한 팬덤을 형성하는 서브컬처 특성상 글로벌 확장성과 구매력을 담보할 수 있다는 설명이다. 이 밖에 지피유엔은 시프트업에서 ‘데스티니 차일드’, ‘니케: 승리의 여신’ 디렉터 출신인 최주홍 대표와 시프트업, 엔씨소프트 등 국내 주요 게임사에서 오랫동안 호흡을 맞춰온 개발진으로 구성됐다. 팀원 모두 모바일 서브컬처 게임 기획부터 개발, 출시, 운영까지 성공적으로 실행하며 노하우를 축적했다. 게임 장르에 대한 높은 이해도를 바탕으로 서브컬처 게임 시장에서 새로운 성공 모델을 만들어 나갈 것이라는 평가다. 회사는 이번 투자 유치를 기점으로 프로젝트 테라리움 개발에 속도를 낼 예정이다. 올해 하반기 쇼케이스에서 최초 공개 후 내년까지 핵심 플레이를 완성한다는 계획이다. 기획과 프로그램, 아트 등 전분야에 걸친 채용도 진행한다.
- 조기폐경, 심장 이완기장애와 심혈관질환 위험성 증가시켜
- [이데일리 이순용 기자] 고려대학교 안암병원 순환기내과 박성미 교수와 용인세브란스병원 심장내과 배성아 교수팀이 최근 연구를 통해 조기폐경 여성의 심장 이완기 기능 이상 및 심혈관질환 위험성 증가 간의 밀접한 연관성을 규명했다.이완기 기능은 심장이 이완될 때 혈액이 심장으로 원활하게 흘러 들어갈 수 있게 하는 기능을 말한다. 이완기 기능이 저하되면 심장이 효율적으로 혈액을 전신에 공급하는 데에 어려움이 발생하게되고, 여러 심혈관질환 및 심부전으로 이어질 수 있어 이완기 기능은 심장건강에 직접적인 중요성을 가지고 있는 것으로 평가되고 있다.연구팀은 2012년 1월부터 2018년 5월까지 대한심장학회 여성심장질환연구회 데이터베이스(KoROSE)에 등록된 환자들 중, 폐경기 여성 795명을 대상으로 평균 771일간 추적 관찰했다.조기폐경(45세 미만)을 겪은 여성들은 정상적으로 폐경을 맞이한 여성들에 비해 이완기 기능 이상의 발생률이 1.55배 높았으며, 주요 심혈관 사건, 급성 관상동맥 증후군, 심부전으로 인한 입원 위험성도 2.28배 높은 것으로 나타났다. 특히 이완기 기능 장애가 없는 여성들에서는 조기폐경이 심혈관 질환 위험증가로 이어지지 않았으나, 이완기 기능 장애가 있는 여성들의 경우, 조기폐경이 심혈관 질환 위험을 2.2배 증가시키는 것으로 관찰되었다.이러한 결과는 조기폐경이 여성의 심혈관 건강에 끼치는 영향이 단순한 호르몬 변화를 넘어선다는 것을 시사한다. 박성미 교수는 “조기폐경의 심혈관계 위험성에 대한 추정이나 단순 빅데이터의 분석결과들이 있었지만, 임상진료에서 환자들을 관찰하여 그 기전을 규명한 연구는 거의 없었다. 조기폐경으로 인한 호르몬 변화가 심장의 이완기능에 직접적인 영향을 줄 수 있음을 확인했다”고 설명하며 “조기폐경 여성의 심혈관질환 관리와 예방에 중요한 고려사항이 될 수 있을 것”이라고 강조했다.또한 박성미 교수는 “조기폐경이 여성의 심장 건강에 미치는 영향에 대한 인식을 높이고, 조기폐경을 경험한 여성들이 적극적인 심혈관질환 예방 및 관리를 받을 수 있도록 의료계 및 일반 대중 사이의 인식 전환을 촉구해야 한다”라고 설명했다.배성아 교수는 이번 연구 결과에 대해 “조기폐경과 심혈관질환 위험성 증가 간의 연관성을 밝힌 이번 연구는 여성의 심장 건강 관리에 있어 중요한 전환점이 될 것”이라고 설명했다.이번 연구 ‘Early menopause is associated with abnormal diastolic function and poor clinical outcomes in women with suspected angina’는 네이처 자매지 SCI급 국제학술지인 ‘Scientific Reports’ 에 실렸다.

- 바른세상병원, 수족부센터 윤영식 원장 영입
- [이데일리 이순용 기자] 관절전문 바른세상병원(병원장 서동원)은 수족부센터에 강원대병원 전공의, 서울대병원전임의 과정을 거쳐 강원대병원 정형외과 교수로 재직한 윤영식 원장(정형외과 전문의)을 영입했다고 밝혔다. 지난 6일부터 진료를 시작한 윤영식 원장은 다양한 임상 경험을 바탕으로 수족부센터에서 골절, 스포츠 손상, 당뇨병성 족부질환, 무지외반증, 족저근막염 등 족관절과 손목터널증후군, 방아쇠수지, 결절종, 척골충돌증후군 등 손과 손목관절, 팔꿈치관절의 수족부질환을 전문적으로 다룬다. 특히, 족부 분야에서는 ‘3차원 다분절 발 모델을 이용한 발목 전치환술 후 분절 운동 변화’, ‘ 발가락 및 발뒤꿈치 보행 시 두 보조기의 신발 내 족압 변인 비교’, ‘한국형 전투화와 운동화의 신발 내 발바닥 압력 비교’ 외에도 다수의 논문이 SCI급 국제학술지 등에 등재되며 학계에서 우수성을 인정받았다. 또한, 대한족부족관절학회 국제위원회 위원으로서 지속적인 연구와 활동을 이어나가고 있다.윤영식 원장은 “바른세상병원의 실력있는 의료진들과 함께하게 되어 기쁘게 생각한다. 우리의 몸은 각자의 위치에서 제 역할을 해낼 때 건강을 유지할 수 있는 것처럼 저 역시 제가 맡은 영역에서 전문성을 발휘하여 건강하고 수준 높은 진료를 제공하겠다”고 말했다.바른세상병원은 무릎과 어깨 등을 치료하는 관절센터와는 별개로 손과 발 등의 작은 관절을 전문적으로 치료하는 수족부 센터를 따로 두어 운영하는 만큼 수족부 질환에 대한 전문성 강화와 수준 높은 의료서비스 제공을 위해 힘써왔다. 한편, 바른세상병원은 정형외과를 중심으로 한 관절센터와 수족부센터 외에도 척추센터, 뇌신경센터, 재활물리치료센터 등 8개과(정형외과, 신경외과, 신경과, 재활의학과, 영상의학과, 마취통증의학과, 내과, 가정의학과) 우수한 의료진들의 협진시스템을 구축하여 검사에서부터 결과 확인, 진료, 수술, 재활까지 가능한 원스톱 진료서비스를 제공하고 있다.

- 지씨셀, T세포 림프종 치료제 국내 임상 1상 IND 제출
- [이데일리 김승권 기자] 지씨셀(144510)은 T세포 림프종(T-cell lymphoma) 치료제로 개발 중인 ‘GCC2005(CD5 CAR-NK)’의 국내 임상1상 임상시험계획승인신청서(IND)를 식품의약품안전처에 제출했다고 10일 밝혔다.회사는 이번 IND 신청을 시작으로 연내에 재발성 또는 불응성 T 세포 악성 종양 환자 치료에서 림프구 제거 화학요법과 병용하는 ‘GCC2005’의 안전성, 내약성 및 예비 유효성을 평가하기 위한 제1상 다기관 임상시험에 돌입할 계획이다.GCC2005는 제대혈(cord blood) 유래 NK세포로 제작되며, T 세포 림프종에서 높게 발현되는 CD5 마커를 표적으로 T세포 림프종을 타깃하는 동종유래(allogeneic) 세포치료제다. CD5는 T세포 림프종 환자의 약 80-90% 환자에서 과발현되어 다른 타겟대비 더 넓은 환자군에서 효과보이길 기대된다.지씨셀 로고지씨셀의 독자적 기술인 키메릭 항원 수용체(CAR)와 IL-15의 공동발현으로 기존 NK세포의 한계점이었던 짧은 지속성을 개선하였으며, CAR-T로 접근 시 정상 T세포 자체도 CD5를 발현하므로 배양 중 CAR-T세포가 서로를 죽이는 동족살해(Fratricide) 현상, 자가 CAR-T의 경우 환자 암세포에도 유전자 도입이 될 수 있으므로 악성(Malignant) CAR-T가 생성되는 제품 오염과 체내 T세포 무형성증(T cell aplasia) 유발 가능 BA 등 기존 CAR-T 치료제의 한계를 CAR-NK 신규 모달리티 개발을 통해 안전성과 독성 부작용 이슈를 보완했다. 또한, 지씨셀의 경쟁력인 CAR-NK 생산 및 동결보관(Cryopreserve) 플랫폼을 통해 자가유래(Autologous) CAR-T 치료제 대비 대량생산과 즉시 투여가 가능한 off-the-shelf 치료제로서의 가격 경쟁력을 갖추고 있다.지난 4월에 열린 미국암연구학회(AACR)에서는 ‘GCC2005’의 비임상 효능평가 결과를 공개를 통해 T세포 림프종에 대한 혁신신약으로서의 가능성을 보여줌으로써 업계의 많은 주목을 받았다.한편, T 세포 림프종(T cell lymphoma)은 림프절 이외의 림프 조직에서 발생하는 NK세포 및 T세포 계열의 림프종이다. 미국, 유럽보다 한국을 비롯한 아시아 국가에서 비교적 흔히 발견되며, 주로 코, 구개, 상기도, 위장관 그리고 피부를 침범한다. 다수의 환자가 비강, 비인두, 하인두, 후두를 포함하는 상기도에 질환의 발병을 보인다. 또한 해당 림프종은 B세포 림프종 대비 치료옵션이 거의 없고 미충족 수요가 높은 희귀난치성 질환이다.

- 디앤디파마텍, 국제 GLP-1 치료제 개발 콘퍼런스에 연사 초청
- [이데일리 박순엽 기자] GLP-1 계열 신약개발 전문기업인 디앤디파마텍(347850)이 오는 15~16일 미국 필라델피아에서 최초로 개최되는 GLP-1 치료제 개발 콘퍼런스(GLP-1-Based Therapeutics Summit)에 6인의 주요 연사로 공식 초청받았다고 10일 밝혔다. 디앤디파마텍 CI (사진=디앤디파마텍)최근 GLP-1 기반 치료제는 비만·MASH (대사이상관련 지방간염)을 포함한 다양한 대사 질환에 혁신적인 치료 옵션으로 관심도가 급격히 상승하고 있다. 해당 시장은 현재 상업 제품을 판매 중인 노보노디스크, 일라이릴리 등 대형 글로벌 제약사들의 주도하에 매년 전 세계 시장 규모가 기하급수적으로 성장하고 있으며, 앞으로 타깃 적응증 또한 지속적으로 확대될 것으로 기대된다. 이러한 트렌드와 산업계 요구에 따라 GLP-1 기반 치료제의 개발 및 상업화 전략, 미래의 기회를 논의하기 위한 국제 콘퍼런스인 ‘GLP-1-Based Therapeutics Summit’이 처음 열린다. 이번 GLP-1 Summit은 GLP-1 기반 치료제 분야의 선두 주자들이 모여 최신 연구 결과와 기술적 혁신을 주제로 토론하기 위해 마련된 장으로, 세계 각국의 제약 및 바이오 기업, 연구 기관, 학계 및 정부 기관 등 다양한 분야의 전문가들이 참석한다. 특히, GLP-1 계열 약물 개발의 선두자로 활약하고 있는 노보노디스크, 일라이릴리 등을 포함하여 사노피, 로슈, 카못테라퓨틱스, 알티뮨 등 주요 글로벌 업체들의 대표와 주요 연구자들이 참석할 것으로 알려졌다. 지난 2일 GLP-1 계열 펩타이드 신약 개발 전문업체로 코스닥에 상장을 완료한 디앤디파마텍은 이번 행사에 주요 연사로 초청됐다. 이슬기 디앤디파마텍 대표는 이번 행사에서 회사가 미국에서 임상 2상 진행 예정인 GLP-1 이중작용제의 MASH 치료 효과와 경구용 GLP-1에 대해 별도 구두 발표할 예정이며, 일라이릴리·알티뮨 등 글로벌 R&D 리더들과 함께 GLP-1 기반 치료제의 미래 적응증 확장 가능성을 논의하는 패널토론의 모더레이터로 진행을 맡을 예정이다. 이 대표는 “GLP-1 계열 펩타이드 전문 기업으로서 이 분야의 글로벌 선두 기업들과 함께 전 세계 환자들을 위한 더 나은 치료 옵션의 미래를 깊이 고민하고 논의할 수 있는 자리가 마련돼 매우 기쁘게 생각한다”며 “치열한 GLP-1 개발 경쟁에서 우위를 점할 수 있도록 현재 개발 중인 GLP-1 기반 치료제들의 신속한 개발을 위해 연구개발에 더욱 매진하겠다”고 말했다.
- 티카로스, '플랫폼 기술수출' 가능성 높인다…적용 범위 확대 연구 돌입
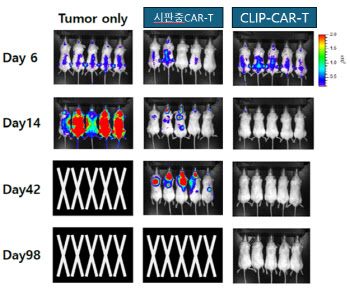
- [이데일리 김진수 기자] 제약바이오 기업의 ‘플랫폼 기술수출’이 대세로 떠오른 가운데, 티카로스가 자체 개발 플랫폼 기술의 적용 범위를 기존 T세포에서 NK세포까지 확대하기 하기 위한 연구를 시작한다.티카로스는 파이프라인 개발 뿐 아니라 향후 비독점적 기술수출이 가능한 플랫폼 기술의 이전도 고려 중인 만큼 플랫폼 기술 적용 범위 확대 가능성을 확인해 가치를 높일 수 있을지 주목된다.9일 티카로스에 따르면 티카로스는 지난달 말 호주의 바이오 기업 카테릭스(CARtherics)와 티카로스의 플랫폼 기술 ‘클립’(CLIP) 활용 공동연구계약을 체결했다. 카테릭스는 유도만능줄기세포(iPSC) 유래 CAR-NK(키메릭 항원 수용체-자연살해) 치료제 개발기업이다.티카로스 CLIP은 세포 면역 시냅스를 강화해 항암 효과를 향상시키는데 중점을 둔 플랫폼 기술이다. 트랜스막 도메인 수정을 통해 면역 시냅스의 형성과 상호 작용을 강화해 항종양효과를 높이는 것이다. CLIP은 티카로스의 메인 파이프라인이자 CAR-T 치료제로 개발 중인 ‘TC011’의 전임상 및 동물실험에서 효과를 나타낸 바 있다.이번에 새롭게 체결한 공동연구의 주된 내용은 카테릭스가 개발하는 CAR-NK 치료제에 티카로스의 CLIP 플랫폼을 적용해 종양살상능이 증진된 CAR-NK 치료제를 만드는 것이다.티카로스는 카테릭스가 지정한 항원을 타깃하는 CLIP 기술 적용 CAR를 제작해 카테릭스에 제공하고, 카테릭스는 이것을 iPSC 유래 NK세포에 적용한 뒤 시험관 내(in-vitro) 및 생체내(in-vivo) 기능을 평가할 예정이다.이재원 티카로스 대표는 이번 계약과 관련해 “독자적인 플랫폼 기술 CLIP이 CAR-T뿐만 아니라 CAR-NK에도 적용될 수 있는지를 알아볼 수 있는 좋은 기회”라며 “플랫폼 기술의 응용 범위를 확장하는 것이기 때문에 큰 의미가 있다”고 말했다.◇CAR-T에선 효과 보인 CLIP, CAR-NK에서는?CLIP은 티카로스가 개발 중인 CAR-T 치료제 ‘TC011’에 적용된 기술로 전임상 및 동물실험에서 효과가 확인된 바 있다. TC011은 재발성 또는 불응성 B세포 림프종을 타깃으로한 CAR-T 치료제로, 국내 CAR-T 치료제 중에서는 세 번째로 본 임상을 허가 받은 물질이다. TC011은 현재 서울대병원, 분당서울대병원, 국립암센터, 세브란스병원 등에서 임상 1상이 진행 중이다.티카로스가 실시한 동물실험 결과를 살펴보면, CLIP이 적용된 CAR-T는 시판 중인 CAR-T 보다 림프종모델에서 항암 효능과 생존율에 있어 크게 향상된 효과를 보였다.또 투여 용량을 1/5로 줄여도 유의미한 효능을 나타냈다. 이는 부작용 측면에서 이상반응을 줄이는 데 도움을 줄 수 있으며 T세포 발현률이 낮은 환자라도 CAR-T의 제작 및 사용이 가능해진다는 점에서 의미가 있다.티카로스 CLIP 플랫폼 기술이 적용된 CAR-T 치료제 동물실험 효능. (사진=티카로스)T세포는 특정 항원에 반응해 세포막 손상, 세포 사멸, 또는 다른 면역 세포를 활성화시키는 등 다양한 면역 반응을 유도한다. 반면, NK세포는 종양 세포 등 변형된 세포나 바이러스 감염된 세포를 탐지하고 파괴하는데 주로 관여한다는 점에서 차이가 있다.이처럼 T세포와 NK세포가 대상 및 작용이 상이하지만 티카로스는 CLIP 기술이 NK세포 치료제에 적용되는 데 문제가 없을 것이라는 입장이다.티카로스 관계자는 “CLIP 기술은 CAR 구조 세포 내 시그널 도메인 또는 세포외 바인딩도메인을 변화시킨 것이 아니고, 단지 세포막 도메인과 힌지 변화만으로 T세포와 암세포의 면역 시냅스를 증진시키는 기전”이라며 “따라서 현재 티카로스가 클립 플랫폼을 적용한 CAR-T 뿐 아니라 CAR-NK에도 적용이 가능할 것으로 보인다”고 말했다.특히, CAR-T 치료제의 경우 B세포 림프종 등 혈액암 등에는 효과적이지만 아직까지 고형암에 대한 효과에는 의문 부호가 붙는 등 적응증 한계가 있는 상황이다. 이에 다양한 고형암 치료에서는 CAR-NK 치료제가 CAR-T의 한계를 보완할 치료제로 주목받고 있다.아직까지 허가받은 CAR-NK 치료제는 없지만, 글로벌 임상시험 정보사이트 클리니컬 트라이얼즈에 따르면 1000여개 이상의 CAR-NK 치료제가 개발 중에 있는 만큼 티카로스는 이번 공동연구를 통해 CLIP 플랫폼의 비독점적 기술수출 가능성을 높일 것으로 기대된다.이 대표는 “티카로스와 카테릭스는 이번 공동연구개발 계약체결 이후 라이센스 계약도 목표로 하고 있다”며 “CLIP 기술이 다양한 파이프라인들에 적용될 수 있는 플랫폼 기술로 진화하기를 기대한다”고 말했다.

- HLB바이오스텝子 크로엔, HLB바이오코드로 사명 변경
- [이데일리 이정현 기자] HLB바이오스텝(278650)은 최근 자회사로 인수한 크로엔이 ‘HLB바이오코드(HLB bioCode)’로 사명을 변경한다고 9일 밝혔다. HLB그룹의 일원으로서 정체성 강화에 나선 모양새다.HLB그룹은 이로써 유효성 비임상 CRO에 이어 GLP 인증 독성 비임상 CRO까지 서비스 영역을 확장하며, 비임상 전주기 원 스톱(One-stop) 서비스를 제공할 수 있게 됐다. HLB바이오스텝은 국내 최대 유효성 비임상 CRO이며, HLB바이오코드는 식약처와 환경부 등 정부 부처의 20개 시험 항목에 대한 GLP 인증을 보유하고 있는 독성시험 전문 비임상 CRO다.새로운 사명은 ‘Cooperation’(협력)과 ‘Development’(개발)의 앞 두 글자를 ‘Code’로 조합한 것으로, 고객사의 신약 개발에 헌신해 함께 성장하겠다는 철학을 담았다.HLB바이오스텝은 문정환 대표가 9일 개최된 HLB바이오코드 이사회를 통해, HLB바이오코드의 대표이사직을 겸직한다고 밝혔다. 비임상을 전문으로 하는 두 회사의 공동 경영을 통해 고객 영업 및 서비스 업무를 효율화하고, 주요 사안에 대한 빠른 의사 결정과 함께 책임 경영을 실현하기 위한 포석이다. 문 대표는 “비임상 시험의 전주기적 서비스를 원스톱으로 제공할 수 있게 된 만큼, 유효성 비임상에 국한됐던 기존의 서비스 영역이 크게 확장되어 더 압도적인 경쟁력을 갖추게 됐다”며, “양사는 상호 긴밀한 협력을 통해 국내를 넘어 글로벌 시장 공략을 본격화하겠다”고 말했다.HLB바이오스텝은 다음 달 미국 캘리포니아 샌디에고에서 개최되는 ‘바이오 USA’에 HLB그룹의 계열사(HLB제약, HLB셀, HLB사이언스)와 공동 부스를 마련해 참가한다. 유효성ᆞ독성 비임상 서비스를 모두 제공할 수 있게 된 만큼 글로벌 시장 확장을 위한 첫 행보다.HLB바이오코드도 HLB바이오스텝의 자회사로 합류한 만큼 추가 GLP 인증을 통해 비임상 영역에서 더욱 전문적이고 폭넓은 서비스를 구현하겠다는 계획이다.