|
아리바이오는 식품의약품안전처로부터 경구용 치매치료제 AR1001 글로벌 임상 3상(Polaris-AD)의 한국 임상시험 승인을 받았다고 29일 밝혔다.
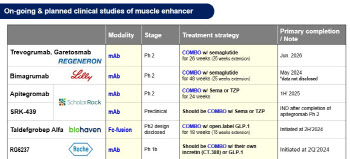
AR1001 글로벌 임상 3상은 미국 600명, 유럽 400명, 한국 150명, 중국 100명을 목표로 총 1250명 규모로 진행중이며, 2022년 12월 미국(FDA)에서 먼저 환자 투약이 시작됐다. 한국 식약처 승인에 이어 유럽(EMA)과 중국 임상 3상도 임상시험계획 신청을 준비 중이다.
또한 AR1001 한국 임상 3상은 복지부 산하 국가임상시험지원재단(KoNECT)의 공익적 임상시험 지원대상 1호로 지정돼 있다. 환자모집을 신속히 진행할 수 있도록 적극적인 지원을 받을 예정이다.
정재준 아리바이오 대표이사는 “이번 글로벌 3상을 통해 임상 2상에서 확인한 AR1001의 효과를 재확인하는 것이 큰 의미가 있다. 미국 환자군을 통해 보인 효과가 한국인, 유럽인 및 중국인에서도 동일하게 보여지는지에 대한 검증의 기회이기도 하다” 며 “처음으로 경구용 알츠하이머병 치료제가 상용화되는데 한 걸음 더 다가간 것이다. 글로벌 임상에 한국을 포함한 것은 AR1001의 최초 상용화 국가 중 하나로 대한민국이 있다는 의미가 크다”고 말했다.









![[포토]이가영,부드러운 티샷 공략](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110100330t.jpg)
![[포토] '트릭 오어 트릿' 진행하는 바이든 대통령 부부](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103102211t.jpg)
![[포토] 송민혁 '이글 2개, 버디7개 잡은 날'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103100152t.jpg)
![[포토]치솟던 배춧값 대폭 하락…"물량 충분해"](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103101370t.jpg)
![[포토]삼성전자 반도체 영업익 4조](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103101369t.jpg)
![[포토]하모니카 연주가 이윤석의 연주](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103101230t.jpg)
![[포토]민통선 주민들 트랙터 시위](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103101122t.jpg)
![[포토] 서울시예산안 설명하는 오세훈 시장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103100890t.jpg)
![[포토] 벤틀리모터스코리아, '더 뉴 컨티넨탈 GT 스피드' 공개](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103100418t.jpg)
![[포토] 2024 서울 문화원 엑스포](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103001770t.jpg)

![[포토]이가영,정상을 바라본다](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110100331t.jpg)
![[단독]대출 74%가 담보·보증대출…위험 피하는 은행](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110100154b.jpg)