현재 글로벌 HDAC 저해제 개발 257건 중 혈액암 138건 (53.7%), 고형암 91건 (35.4%)으로 유방암, 폐암, 신세포암, 난소암 등 다양한 암 종에 적용되고 있다. 췌장암 적응증으로는 아이발티노스타트가 유일하다.
미국 식품의약국(FDA)로부터 승인된 HDAC 저해제 약물은 머크의 ‘Zolinza’(피부 T-세포림프종), 셀진의 ‘Istodax’(피부 T-세포림프종/말초 T-세포림프종), 온세오의 ‘Beleodaq’(말초 T-세포림프종), 노바티스의 ‘Farydak’(다발성골수종) 적응증으로 모두 글로벌 빅팜에서 판매하고 있으며, 혈액암으로만 허가된 바 있다.
아이발티노스타트는 Class I, Class IIb HDAC만을 강하게 억제하는 우수한 효능이 있어서 이 외에 단백질들을 저해하지 않으므로 기존의 췌장암 치료제와는 다르게 정상세포에서의 심각한 부작용은 관찰되지 않는다.
|
특정 암세포에서 분화 정지를 유도하며, 이 분화 과정을 통해 암세포를 덜 공격적으로 만들고 화학 요법이나 방사선 치료와 같은 다른 병합 치료에 효과를 보다 높이기 위해 암세포를 더 취약하게 할 수 있다.
이 같은 기전 임상을 통해 입증 된 바 있다. 아이발티노스타트+젬시타빈+엘로티닙 3제 병용요법 임상 2상에서 목표했던 6주기 약물 투약을 완료한 군(PP) 10명의 종양평가결과 부분관해(PR) 3명(30%), 안전병변(SD) 7명(70%)이었고, 진행병변(PD)은 없었다. 따라서 질병통제율(DCR)은 100%로 10명 모두 약물에 의한 효과를 보였다.
모든 유효성 평가지표에서 다수의 논문으로 보고된 젬시타빈+엘로티닙 병용요법 임상결과 대비 6주기의 약물 투약을 완료한 군의 객관적반응률(ORR), 전체생존율의 중앙값(mOS)은 각각 2.2, 1.6배가량 개선됐다.
올 4분기에 진행하는 미국 임상 2상을 통해 진행성 또는 전이성 췌장암 환자 중 폴피리녹스 요법 후 질병이 진행되지 않는 환자 총 52명을 대상으로 아이발티노스타트와 카페시타빈(capecitabine)을 병용군과 카페시타빈 단독군을 비교해 1차 유효성 평가지표(Primary endpoint)인 무진행생존기간(PFS) 등을 평가한다.
CG인바이츠 관계자는 “췌장암 1차 치료제에 반응을 보이고 있는 환자들의 전체생존기간(Overall survival)과 삶의 질에 대한 개선이 매우 요구되고 있어 임상 1b상에 참여한 임상시험책임자(PI)는 올해 4분기부터 시작하는 아이발티노스타트의 유지요법(Maintenance therapy) 임상 2상 시험을 자신하고 있다”고 말했다.









![[포토]현세린,정확한 임팩트](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110100215t.jpg)
![[포토] '트릭 오어 트릿' 진행하는 바이든 대통령 부부](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103102211t.jpg)
![[포토] 송민혁 '이글 2개, 버디7개 잡은 날'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103100152t.jpg)
![[포토]치솟던 배춧값 대폭 하락…"물량 충분해"](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103101370t.jpg)
![[포토]삼성전자 반도체 영업익 4조](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103101369t.jpg)
![[포토]하모니카 연주가 이윤석의 연주](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103101230t.jpg)
![[포토]민통선 주민들 트랙터 시위](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103101122t.jpg)
![[포토] 서울시예산안 설명하는 오세훈 시장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103100890t.jpg)
![[포토] 벤틀리모터스코리아, '더 뉴 컨티넨탈 GT 스피드' 공개](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103100418t.jpg)
![[포토] 2024 서울 문화원 엑스포](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/10/PS24103001770t.jpg)

![[포토]홍진영,첫 홀 버디 들어가라](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110100274t.jpg)
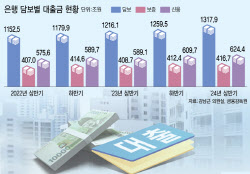
![[단독]대출 74%가 담보·보증대출…위험 피하는 은행](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110100154b.jpg)
![‘AI투자 확대 우려’에 나스닥 2.76%↓…금감원, 고려아연 유증 제동[뉴스새벽배송]](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/11/PS24110100413b.jpg)
