21일 업계에 따르면 한화케미칼은 오송공장 양도를 위한 우선협상대상자로 바이넥스를 선정했다. 약 1000억원을 투자해 바이오의약품 공장을 준공했지만 한 번도 가동하지 않고 공장 매각을 결정했다. 바이오시밀러 시장 진출을 선언한 국내업체 중 첫 중도 포기 사례다.
한화케미칼이 바이오시밀러 연구 분야에서 성과가 없었던 것은 아니다. 지난해 11월 국내 업체 중 셀트리온에 이어 두 번째로 바이오시밀러 ‘다빅트렐’을 허가받았다. 2010년 류마티스관절염 치료제 ‘엔브렐’의 바이오시밀러 개발을 위한 임상시험에 착수한 이후 4년만에 시판 허가를 받았다.
사실 우여곡절도 많았다. 2012년 9월 식약처에 판매허가를 신청했지만 자료 미비로 허가가 지연되면서 허가심사만 2년 넘게 소요됐다. 2011년 6월 미국 머크와 7800억원 규모의 판매 계약을 맺었지만 이듬해 계약 해지를 통보받기도 했다.
한화케미칼은 지난 1월 독일 머크세로노와 ‘다빅트렐’의 기술 수출 계약을 맺었지만 기술 이전 절차와 공장매각을 완료하면 바이오의약품 분야는 손을 뗄 예정이다. 그룹 차원에서 의약품 부문이 핵심사업에서 제외하면서 사업 철수도 일사천리로 진행되는 셈이다.
LG생명과학 관계자는 “바이오시밀러는 개발 난이도가 높아 최대한 신중하게 접근하고 있다”면서 “시판허가가 가시화할 때 공장 확장 등에 나설 계획이다”고 설명했다.
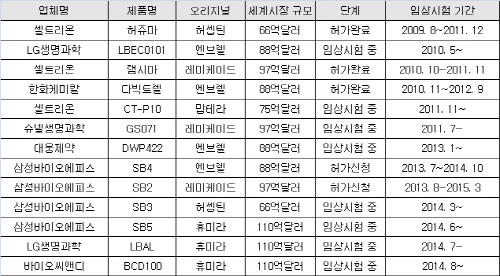
|
삼성바이오에피스는 ‘레미케이드’와 ‘엔브렐’ 바이오시밀러 제품인 ‘SB2’와 ‘SB4’ 모두 임상 시작 1년여만에 임상시험을 마치고 국내와 유럽 허가를 신청했다. 현재 ‘허셉틴’과 ‘휴미라’ 바이오시밀러의 국내외 임상시험을 진행 중이고, ‘란투스’ 바이오시밀러는 해외에서 임상시험이 마무리 단계에 있다.
삼성바이오로직스는 지난 2012년말 인천 송도 27만3900㎡규모의 부지에 3400억원을 투자해 3만ℓ 규모의 공장을 준공했다. 여기에 올해 완공을 목표로 15만ℓ 규모의 두 번째 공장을 짓고 있다. 삼성바이오에피스 역시 미국의 바이오젠아이덱, 머크 등과 바이오시밀러 개발 및 상업화 계약을 맺으면서 해외 진출도 준비 중이다.
한편 셀트리온(068270)은 삼성의 거센 추격에도 아직까지는 독보적인 위치를 점유하고 있다. 셀트리온은 지난 2010년 10월 ‘램시마’의 임상시험을 시작한 이후 1년 9개월만인 2012년 7월 국내 허가를 받았다. 이후 유럽, 일본, 캐나다 등에 진출했고 올 하반기 미국시장에 입성을 앞두고 있다. 아직 1개 품목 허가도 받지 않은 후발주자보다 최소 3년 이상 앞선 셈이다. 셀트리온의 두 번째 바이오시밀러 ‘허쥬마’도 지난해 허가받고 국내외 시장을 정조준한 상태다.
업계 한 관계자는 “바이오시밀러는 복제약이지만 신약 수준의 개발 난이도가 요구되기 때문에 임상시험 진입부터 시판허가까지 넘어야 할 산이 많다”면서 “회사 차원의 전폭적인 지원과 함께 시행착오를 최대한 줄이려는 노력이 동반되지 않으면 경쟁업체들에 뒤쳐질 수 밖에 없다”고 조언했다.


![월드컵까지 따냈다...스포츠산업 '생태계 파괴자' 된 빈살만[글로벌스트롱맨]](https://image.edaily.co.kr/images/Photo/files/NP/S/2023/11/PS23110500115t.jpg)

![[포토] 폭염 속 휴식취하는 건설 근로자](https://image.edaily.co.kr/images/Photo/files/NP/S/2023/08/PS23080100718t.jpg)






![[포토] 아프리카 문화 페스티벌 열리는 광화문광장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/05/PS24051000582t.jpg)
![[포토]넷플릭스 '더 에이트 쇼' 주역들](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/05/PS24051000196t.jpg)
![[포토] 문경준의 컨트롤](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/05/PS24051000075t.jpg)
![[포토] 김홍택 '연속 우승에 도전한다'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/05/PS24050900280t.jpg)

![[포토] 벼 드문모심기 일관농작업대행 시연회](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/05/PS24050901414t.jpg)
![[포토] APC 운영협의회 인사말하는 강호동 농협회장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/05/PS24050901395t.jpg)
![[포토]뱅크시 작품에 대해 소개하는 유한일 상무](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/05/PS24050901052t.jpg)
![[포토]'대화하는 윤재옥-이철규'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/05/PS24050901021t.jpg)
![[포토]윤석열 대통령, '취임 2주년 기자회견 생중계'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/05/PS24050900686t.jpg)

![[포토]박결 '클럽 선택의 시간'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/05/PS24051000331t.jpg)