[이데일리 권효중 기자]
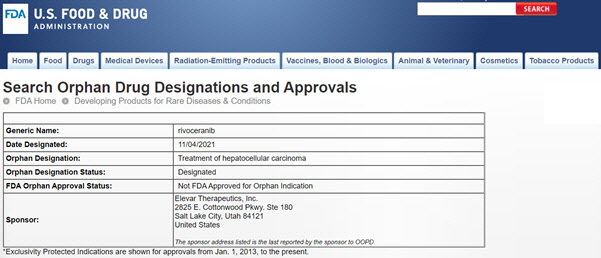
에이치엘비(028300)는 글로벌 권리를 보유한 표적항암제 ‘리보세라닙(rivoceranib)’이 지난 4일 미국 식품의약국(FDA)으로부터 간암에 대한 희귀의약품(orphan drug designation)으로 지정받았다고 8일 밝혔다.
 | | (사진=FDA 홈페이지) |
|
FDA의 희귀의약품 지정은 희귀·난치성 질병의 치료제 개발 및 허가가 원활하게 이뤄지도록 지원하는 제도다. 희귀의약품에 지정되면 신약 개발사는 임상시험 승인 및 허가 기간 단축, 전문의약품 허가 신청비용(User Fee) 면제, 세금감면, 허가 취득 후 7년간 시장 독점권 등 다양한 혜택을 누릴 수 있게 된다.
에이치엘비는 리보세라닙과 면역항암제 ‘캄렐리주맙(camrelizumab)’의 병용요법으로 간암 1차 글로벌 임상 3상을 진행중이다. 캄렐리주맙이 올해 4월 간암에 대한 희귀의약품으로 지정된데 이어 리보세라닙까지 희귀의약품에 지정됨에 따라 향후 허가기간에 상당한 단축이 예상된다.
현제 리보세라닙의 간암1차 임상 3상은 전체 생존 기간(OS), 무진행 생존 기간(PFS)을 1차 평가 지표로 삼아 비교 약물과 대조하는 방식으로 한국, 미국, 유럽, 중국, 대만 등에서 진행 중이다. 총 510명의 환자 모집이 완료됐으며, 국내에서는 서울아산병원, 삼성서울병원, 서울대학교 병원 등 10곳에서 진행되고 있다.
리보세라닙은 혈관내피세포수용체(VEGFR)-2를 억제하는 경구용 항암물질로 신생혈관 생성을 억제하고 혈관을 정상화하며 면역세포를 활성화시켜준다. 이러한 기전으로 세포독성항암제, 면역항암제 등 다른 종류의 항암제와 범용성이 좋고 부작용이 적다. 특히 중국에서는 2020년 3월, 같은 해 12월 캄렐리주맙과 리보세라닙이 각각 간암 2차 치료제로 승인 받아 시판 중이며, 리보세라닙의 임상 결과는 세계적 권위의 논문 ‘란셋’에도 실린 바 있어 두 약물의 병용치료 효능에 대한 기대감은 매우 높다.
앞서 리보세라닙은 지난 2017년 6월 FDA로부터 위암에 대한 희귀의약품으로 지정됐으며 2021년 2월에는 선양낭성암에 대해서도 희귀의약품으로 지정된 바 있다.
한편 에이치엘비는 간암 1차 임상 3상 외에도 리보세라닙을 말기 위암 치료제로 판매허가신청(NDA)을 준비하고 있으며 선양낭성암 1차 2상, 위암 1차 2상, 대장암 3차 1b/2상을 동시에 진행 중이다. 선양낭성암은 미국, 한국에서 환자모집이 완료된 상태다.


![월드컵까지 따냈다...스포츠산업 '생태계 파괴자' 된 빈살만[글로벌스트롱맨]](https://image.edaily.co.kr/images/Photo/files/NP/S/2023/11/PS23110500115t.jpg)

![[포토] 폭염 속 휴식취하는 건설 근로자](https://image.edaily.co.kr/images/Photo/files/NP/S/2023/08/PS23080100718t.jpg)







![[포토]국군장병 취업박람회 인재 채용](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042900871t.jpg)
![[포토]멘토들 강연 경청하는 오세훈 시장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042900762t.jpg)
![[포토]KT그룹, AI로 미디어·콘텐츠 산업 '가속도'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042900526t.jpg)
![[포토] 한우자조금, "한우로 행복하세요~"](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042900479t.jpg)
![[포토]'국민의힘 당선자 총회'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042900379t.jpg)
![[포토] '미래전략포럼' 개회사하는 박재완 위원장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042900377t.jpg)
![[포토]'최고위 참석하는 이재명 대표'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042900358t.jpg)
![[포토] 임성재의 우승 본능](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042800425t.jpg)
![[포토]이정민 '구름 갤러리와 함께 입장'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042800395t.jpg)
![[포토]파워에이드와 함께 다 마신 페트병 재활용 하세요!](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042800282t.jpg)
