[이데일리 나은경 기자] 유틸렉스(263050)가 기대주인 항VSIG4 항체치료제 임상 1상 첫 환자 투약을 마쳤다. 지난 3월 식품의약품안전처로부터 임상 1상 계획 승인을 받은 이후 연일 임상 진행에 속도를 내는 모습이다. 연초 진행한 파이프라인 중심의 조직개편이 임상 진행 속도를 높이는 데 영향을 미친 것으로 분석된다. ‘혁신신약’(First-in-Class)을 노리는 고형암 대상 항VSIG4 항체치료제의 기술이전 기대감도 높아지고 있다.
IND 변경 승인 한달만 첫 투약 개시…“이례적”
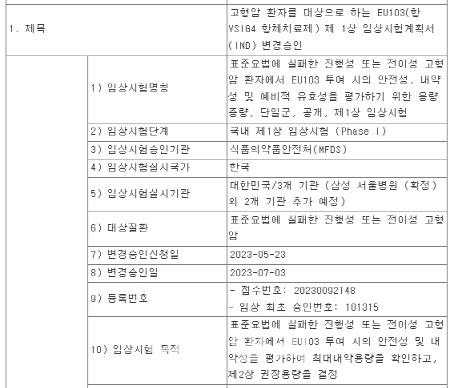
9일 유틸렉스에 따르면 전날 ‘EU103’ 임상시험 1상의 첫 환자 투여를 마쳤다. 임상 1상은 2026년 4월 종료를 목표로 하며, 표준요법에 실패한 진행성·전이성 고형암 환자 15명에게 정맥주사(IV)로 EU103을 단회 투여해 약물의 안전성과 내약성을 확인하는 것이 골자다.
|
코호트별로 투여 용량을 달리해 최대 내약용량을 확인하고 임상 2상에서의 권장용량을 결정하게 된다. 안전성 확인이 목표지만 실제 암환자를 대상으로 투여하는 만큼, 투여에 따라 종양미세환경 개선 및 항종양 효과 증대도 일부 기대된다.
EU103은 종양미세환경(TME) 내 면역억제성 대식세포(M2)가 암살해 세포로 알려진 T세포를 억제하는 것을 차단하고, M2를 면역활성화 대식세포(M1)로 변환시키는 이중기능을 한다. 앞서 진행된 동물실험에서는 종양미세환경 주변 면역세포(T세포, NK세포 등)까지 활성화하는 효과도 확인한 바 있다.
지난달에는 대학병원 연구진과 임상개시모임(SIV)을 진행했다. SIV는 연구진들이 구체적인 임상 진행방법 및 일정을 확인하는 자리로 본격적인 환자 모집을 위한 마지막 단계다. 보통 환자모집에 많은 시간이 소요됨을 감안하면 SIV 후 한 달이 채 되지 않아 대상자 모집이 이뤄진 것은 이례적이다.
유연호 유틸렉스 대표이사는 “EU103 기전에 대한 관심으로 임상기관에서 기대보다 신속하게 환자 모집이 진행되고 있다”며 “회사와 임상기관이 합심해 성공적 임상 수행을 위한 총력을 기울이는 중”이라고 설명했다.
경영전문가를 대표로…눈에 띄는 속도 개선
유틸렉스는 올 연말 관리종목지정유예 기간이 만료될 예정이어서 신약개발 및 신사업 성과를 내기 위해 전사 역량을 집중하고 있다. 지난 3월 제약·바이오 전문가였던 최수영 전 사장이 물러나고 유연호 사장이 공동대표로 선임된 것도 연구개발 중심 회사에서 앞으로는 본격적으로 세를 키우며 회사 경영에도 힘을 싣겠다는 창업주 권병세 회장의 의중이 반영된 것으로 보인다.
유 사장은 서울대학교 영문학과와 동 대학원 경영학과를 졸업한 뒤 경영 컨설턴트로 커리어를 시작해 회계·경영 컨설팅펌인 PwC의 파트너로 활동했다. PwC 컨설팅사업부문이 IBM에 매각된 뒤 IBM 미국 본사, 삼성에스디에스(018260)를 거친 경영전문가다.
|
유 사장은 부임 직후 신약개발을 위한 의사결정 속도를 높이기 위해 조직 개편부터 단행했다. 지난 5월 플랫폼 기술 중심에서 각 파이프라인 중심으로 전사 조직을 바꿨다. 연구소, 신약개발본부, 의약품 제조 및 품질관리기준(GMP) 등 전사 조직을 파이프라인 중심으로 짜고, 임상 진행 파이프라인은 정규 조직화해 각 파이프라인별 전문가들을 전진 배치했다. 파이프라인별 성과 측정 및 보상을 명확하게 볼 수 있어 개발 가속을 위한 임직원들의 동기부여에도 도움이 될 것으로 기대됐다.
EU103 첫 환자 투여가 예상보다 빨리 진행된 것은 상반기 조직개편 이후 첫 성과다. 특히 EU103은 글로벌 시장에서 VSIG4를 타깃으로 하는 후보물질 중에서도 개발 속도가 가장 빠른 편이라 개발에 속도를 내 혁신신약으로 만들기 위한 회사의 의지가 크다.
공식적인 임상 1상 종료목표 시점은 2026년 4월이지만 첫 환자 투약 시점이 앞당겨진 만큼 전체 임상 기간 단축도 기대할 수 있다는 게 회사의 판단이다. 임상 1상 종료시점까지 기다리는 것이 아니라 중간에 확보된 안전성 데이터를 토대로 글로벌 회사들과 기술이전 및 파트너십 논의를 이어가겠다는 게 회사의 목표다.
유 대표는 “보통 이 계열의 경쟁 후보물질들은 M2 기능을 차단하거나 억제하는 데 주로 포커스가 맞춰져 있는데, EU103은 여기에 더해 M2를 M1으로 바꾸는 역할까지 하기 때문에 글로벌 제약사도, 임상사이트에서도 관심이 많다”며 “임상 1상 종료 후 기술이전 논의가 본격 추진되겠지만 임상 1상 중 기술이전도 염두에 두고 있다”고 말했다.


![월드컵까지 따냈다...스포츠산업 '생태계 파괴자' 된 빈살만[글로벌스트롱맨]](https://image.edaily.co.kr/images/Photo/files/NP/S/2023/11/PS23110500115t.jpg)

![[포토] 폭염 속 휴식취하는 건설 근로자](https://image.edaily.co.kr/images/Photo/files/NP/S/2023/08/PS23080100718t.jpg)






![[포토] 길놀이 공연 보며 즐기는 어린이날 연휴 첫 날](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/05/PS24050400242t.jpg)
![[포토]박결 '돋보이는 미소 손인사'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/05/PS24050400173t.jpg)
![[포토] 이정환 '버디 성공하며 갤러리에 인사'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/05/PS24050400154t.jpg)
![[포토]정지민 '투온을 노린다'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/05/PS24050300580t.jpg)
![[포토] 강경남 '호쾌한 샷으로 우승에 도전'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/05/PS24050300330t.jpg)

![[포토]'국민의례하는 개혁신당'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/05/PS24050300541t.jpg)
![[포토] 환상적인 서커스](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/05/PS24050300481t.jpg)
![[포토]황우여, '보수 정당 정체성 확고히 하겠다'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/05/PS24050300465t.jpg)
![[포토]큰절로 인사하는 박찬대-박성중-김용민](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/05/PS24050300463t.jpg)
![[포토]박결 '햇살 미소 출발'](https://spnimage.edaily.co.kr/images/Photo/files/NP/S/2024/05/PS24050400174t.jpg)
![[이車어때]"이 감성 어떻게 잃어"…클럽맨과 '헤어질 결심'](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/05/PS24050400063t.jpg)