뉴스 검색결과 4,508건

- [딥노이드 대해부]①휴대폰 개발하던 사업가, 의료AI에 매료
- 코로나19가 세계를 강타하면서 제약·바이오 산업의 중요도가 커졌다. 급성장세를 거듭하는 제약·바이오 산업은 자동차, 반도체 등에 이어 한국의 차세대 미래성장동력으로 자리매김할 것이 확실시된다. 이데일리의 제약·바이오 프리미엄 뉴스 서비스 ‘팜이데일리’에서는 한국을 이끌어 갈 K-제약·바이오 대표주자들을 만나봤다. 이번에는 인공지능(AI) 의료 진단보조소프트웨어 개발 기업 ‘딥노이드(315640)’다.[이데일리 나은경 기자] “미국, 유럽과 비슷한 시기 시작한 의료인공지능(AI) 산업은 오히려 한국이 글로벌 시장에서 앞서 있어 의료산업 중에서는 가장 유망한 분야라고 봅니다. 문제는 이 차이를 어떻게 계속 유지해 가느냐인데, 의료AI 산업에서 퀀텀점프가 이뤄지려면 국가에서 수가 문제를 해결해 줘야 합니다.”최우식 딥노이드 대표(사진=딥노이드)최근 서울 구로구 딥노이드 본사에서 만난 최우식 대표는 “제약·바이오 산업은 미국, 유럽 위주로 이미 판이 짜여 우리나라 같은 신흥국이 역량을 발휘하기에는 장벽이 높다”며 이같이 말했다.미국 제약사 중 시가총액 1위인 일라이릴리는 1876년 설립된 148년 역사의 기업이고, 유럽에도 머크(독일, 1668년 설립), 로슈(스위스, 1896년 설립) 등 백여년의 역사를 가진 제약사들이 많다는 점을 지적한 말이다. 그는 “대표적으로 미국 식품의약국(FDA) 신약 허가 과정도 영어라는 언어장벽에서부터 시작해 전체적으로 자국 기업에 익숙하고 유리한 방식으로 제도가 짜여 있다”며 “이미 틀이 잡힌 시장에 후발주자로 들어가는 것보다는 이제 막 규칙이 만들어지고 있는 시장에 들어가는 것이 유리하다고 봤다”고 AI의료영상기기 사업을 시작한 이유를 설명했다.최 대표의 깨달음은 20여년의 사업 경험에서 나온 것이다. 한화그룹의 한화정보통신에서 휴대폰 개발로 직장 생활을 시작한 최 대표는 삼성전자를 거쳐 휴대폰 개발업체 애플톤을 창업하면서 사업가로 변신했다. 하지만 이 과정에서 기득권과 경쟁하며 많은 어려움을 겪었다. 그는 “새로운 것을 해야 산업 경쟁력이 생긴다고 생각했고, 알파고 공개를 전후로 AI 관련 사업을 모색하던 도중 데이터가 많은 의료시장이 성장성이 있다고 판단하면서 2008년 회사를 설립했다”고 했다. 현재 산업AI 부문을 총괄하는 김태규 전무가 공동창업자다.딥노이드는 과학기술정보통신부와 정보통신산업진흥원이 주관하는 AI바우처 제도를 통해 임상현장의 수요를 파악했다. AI바우처란 정부가 예산을 지원해 AI 관련 제품을 산업현장에서 시범적으로 활용할 수 있도록 하는 제도다. AI 의료기기가 보험코드를 받지 못해 급여 처방이 불가능하고 신의료기술평가 전이라 비급여 처방이 되지 않더라도, AI바우처 제도를 이용하면 병원에서는 큰 비용부담 없이 진료에 관련 제품을 활용할 수 있고, 개발사도 매출을 낼 수 있다.보건의료빅데이터 개방시스템에 따르면 국내 연간 영상촬영 건수는 엑스레이, 컴퓨터단층촬영(CT), 자기공명영상(MRI), 자기공명혈관조영술(MRA)을 모두 포함해 2억1900만건에 달한다. 같은 해 국내 영상전문의 수가 3910명이었음을 감안하면 영상전문의 1명당 하루 평균 224건(연 근무일수 250일 기준)을 판독해야 한다는 이야기가 된다.글로벌 AI의료영상기기 시장 규모(자료=딥노이드)최 대표는 “의료산업이 ‘치료’에서 ‘예방’으로 패러다임이 바뀌고 사회는 고령화되면서 의료영상 데이터는 급증하는데 영상전문의 수는 4000명에도 미치지 못하고 증감에 큰 변화도 없다”며 “인구가 많은 수도권 지역 영상전문의는 400건 안팎을 하루에 처리해야 한다는 이야기다. 그러다 보면 AI 의료영상기기의 도움을 받아 업무효율성을 높이려는 영상전문의의 수요와 기본적인 부분은 직접 보고 환자들에게 알려주고 싶다는 비영상전문의들의 수요가 있더라”라고 말했다.하지만 사업적으로 유의미한 매출을 내려면 결국 보험 수가가 적용돼야 한다. 뇌혈관 자기공명혈관조영술(MRA) 진단보조 AI 소프트웨어인 딥노이드의 ‘딥뉴로’(DEEP:NEURO)는 지난 14일 한국보건의료연구원(NECA)의 혁신의료기술평가 심사를 통과해 이르면 3분기부터 비급여 처방이 가능해질 것으로 예상된다. 이후 보험 수가 적용을 위한 절차도 차례로 밟을 예정이다.6월 말 기준 딥노이드의 최대주주는 최 대표로 19.99%의 지분을 보유하고 있다. 공동창업자인 김태규 전무가 15.61%로 그 뒤를 잇는다. 소액주주 수는 상반기 기준 2만7481명으로, 전체 주식 수의 약 63.34%를 소유하고 있다.

- [CAR-면역세포 치료시대]②CAR-NK 대표 美바이오텍 주춤...‘타케다·지씨셀’ 선두권
- [이데일리 김진호 기자] 면역세포가 암세포 표면에 항원을 타깃할 수 있도록 유전자 변형을 가한 항체를 달아주는 ‘키메릭항원수용체(CAR)-면역세포 치료제 시대가 활짝 열리고 있다.이 시장의 개화를 알린 CAR-T 시장은 이미 글로벌 제약사(빅파마)들이 선점에 성공한 모양새다. 이에 각국의 제약·바이오기업은 차기 CAR-면역세포 신약을 상용화하기 위해 경쟁적으로 나서고 있다. 그 중심에 서 있는 것이 자연살해(NK)세포에 CAR를 발현시킨 CAR-NK다. 최근 페이트 테라퓨틱스(페이트)나 엔카르타 테라퓨틱스(엔카르타)등 CAR-NK 개발 최전선에 있던 미국 바이오텍들이 효능 부진으로 애를 먹고 있다. 이 와중에 일본 타케다와 국내 지씨셀(144510) 등은 CAR-NK 시장 개척을 위한 임상에 진입해 주목받고 있다.(제공=게티이미지, 각 사)◇최전선 달리던 ‘페이트·엔카르타’는 주춤CAR-NK치료제 신약 개발에서 가장 앞서 있던 미국 바이오텍들이 난항을 겪고 있다. 먼저 체세포를 되돌리는 유도만능줄기세포(iPSC) 기반 CD19 타깃 CAR-NK치료제 후보물질 ‘FT596’로 최초로 임상에 진입했던 페이트는 전면 구조조정에 들어갈 정도로 상황이 좋지 않다. 회사 측이 2021년 B세포 비호지킨 림프종 환자 11명을 대상으로 진행한 FT516의 임상 결과 투약 3개월 시점까지 완전관해율(CR)이 6명에 달했지만, 이후 암이 재발하며 지속성 문제가 불거진 것이다. 지난 1월 회사 측은 직원 50%를 줄이겠다는 구조조정안을 발표했다.CAR-NK치료제 개발 최전선 기업으로 알려졌던 엔카르타도 최근 후보물질의 효능이 부진한 것으로 나타나면서 비상이 걸렸다. 지난 6월 엔카르타는 자사의 NKG2D 발현 CAR-NK 신약후보 ’NKX101‘로 진행한 재발성 불응성 급성골수성백혈병(AML)과 골수이형성증후군(MDS) 적응증 관련 추가 환자 대상 임상 1상의 고용량 투여 결과 완전 관해율(CR)이 약 20% 수준으로 나왔다고 밝혔다. CAR-T치료제 개발 업계 관계자는 “약물의 효능은 CR이 30% 이상은 돼야 의미가 있다고 간주한다”며 “다만 엔카르타의 물질의 CR이 낮았지만, 개발사가 포기할 단계는 아니다. 환자 수를 늘리거나 용량을 조절해 이를 뒤엎는 결과를 얻을 가능성도 남아 있다”고 말했다. ◇CAR-NK로 CAR-T 시장 노리는 日‘타케다’페이트와 엔카르타가 주춤하는 사이 타케다가 다크호스로 떠올랐다. 이 회사는 기존에 시판된 CAR-T치료제와 같은 적응증을 가진 CAR-NK 신약 후보물질을 개발하고 있다. 타케다는 2019년 미국 텍사스대 MD엔더슨 암센터로부터 제대혈 유래 NK세포에 CD19 또는 B세포성숙항원(BCMA) 등을 타깃하는 CAR를 발현시킨 4종의 CAR-NK 신약 후보물질의 상용화 권리를 기술이전받았다. 회사는 2021년 11월부터 이 계약을 통해 획득했던 CD19 타깃 CAR-NK 신약 후보 ‘TAK-007’을 재발성 및 불응성 B세포 비호지킨 림프종 환자 대상 으로 미국 내 임상 2상을 진행하는 중이다.이 분야에서는 CD19(4종) 및 BCMA(2종) 등 6종의 CAR-T치료제가 이미 시판돼, 지난해 기준 20억~30억 달러의 시장을 형성하고 있다. 타케다 측은 “자사 TAK-007이 효능만 입증해 허가 된다면, 범용성을 띤 CAR-NK가 기존 CAR-T 시장을 충분히 진입할 수 있을 것”으로 분석하고 있다. 지씨셀의 CAR-NK 신약 후보물질 개발 현황.(제공=지씨셀)◇지씨셀, CAR-NK로 HER2 고형암 정복 노린다국내사 중 미국에서 CAR-NK의 임상을 진행 중인 기업은 지씨셀뿐이다. 지난해 9월 지씨셀은 미국 관계사인 아티바 바이오테라퓨틱스를 통해 HER2 타깃 CAK-NK 신약 후보에 대해 유방암이나 위암, 위식도접합부 선암 등 고형암 환자 대상 임상 1/2상을 승인받았다. 지난 1일 해당 임상의 본격 개시됐으며, 총 투약 목표 인원은 133명으로 알려졌다. 아티바에 따르면 AB201은 난소암이나 위암 등 동물모델에서 기존에 가장 널리 쓰이는 항체치료제 ‘허셉틴’(성분명 트라스투주맙) 대비 높은 생존률을 기록했던 것으로 알려졌다. 아티바는 CD19 타깃 ‘AB202’(B세포 림프종)와 CD5 타깃 ‘AB-205’ 등 추가 CAR-NK 후보물질의 전임상 연구도 수행하고 있다.한편 아티바는 지난해 1월에는 미국 머크(MSD)와 18억8100만 달러 (당시 한화 약 2조원 )규모의 CAR-NK 후보물질 3종을 공동개발하는 계약을 체결해 주목받았다. 이후 양사는 CAK-NK 후보물질 2종을 공동 개발해 왔으며, 지난달 머크가 이중 1종을 유망한 신약 후보물질로 선정해, 전임상 단계에 돌입한 것으로 알려졌다. 지씨셀 관계자는 “우리 물질을 머크가 재차 인정해 고무적이다. 하지만 현재 관련 진행 상황을 언급할 부분은 없다”고 말했다.CAR-면역세포 신약 개발 업계 관계자는 “CAR-NK 개발에서 일부 기업의 명암이 엇갈리고 있다”며 “어떤 기업이 해당 시장을 개척할지 장담할 수 없다. 하지만 글로벌 제약사인 머크가 높게 평가한 물질이 나온 만큼 K-바이오가 그 주인공이 될 수 있다”고 전망했다. 이밖에도 HK이노엔(195940)이 네덜란드 바이오텍 글리코스템으로부터 CAR-NK 후보를 기술도입해 연구개발을 진행 중이다. 테라페스트가 페이트처럼 iPSC 유래 CAR-NK 후보 ‘TB-100’을 발굴해 내년 중 식품의약품 안전처에 임상시험계획서(IND)를 제출할 준비를 하고 있다.

- [뉴스새벽배송]美 생산자물가지수 반등…나스닥 0.7%↓
- [이데일리 김응태 기자] 뉴욕증시가 혼조 마감했다. 미국의 7월 생산자물가지수가 예상치를 웃돌면서 인플레이션 우려가 다시 제기되면서다. 캐시우드가 엔비디아를 매도했다는 소식에 큰 폭 하락하면서 반도체 관련주 전반이 부진했다. 반면 일라이릴리는 비만 치료제에 대한 기대 심리 속 강세를 나타냈다. 국제유가는 세계에너지기구(IAEA)에서 원유 수요가 확대될 것이란 전망에 상승했다. 중국의 대형 부동산 개발업체인 비구이위안(컨트리가든)이 채무불이행으로 채권 거래가 중단돼 경기 우려가 고조되고 있다. 김정은 북한 국무위원장은 군수공장을 시찰하며 미사일 생산능력 제고의 필요성을 대대적으로 강조했다. 러시아는 흑해곡물협정 중단 이후 흑해를 지나가는 상선에 경고 사격을 실시하며 긴장감이 커지고 있다. 다음은 14일 개장 전 주목할 만한 뉴스다.미국 뉴욕증권거래소(NYSE) 입회장에서 스페셜리스트들이 포스트에 모여 업무를 처리하고 있다. (사진=연합뉴스)◇美 증시, 인플레 우려 속 혼조세-14일 마켓포인트에 따르면 11일(현지시간) 뉴욕증권거래소(NYSE)에서 다우존스30산업평균지수는 전장보다 0.30% 상승한 3만5281.40으로 마감.-스탠더드앤드푸어스(S&P)500지수는 전거래일 대비 0.11% 내린 4464.05 기록. 기술주 중심의 나스닥 지수는 0.68% 밀린 1만3644.85로 집계.-뉴욕증시는 생산자 물가지수가 예상치를 웃돌면서 약세.-에너지 가격 상승 영향으로 8월 물가 우려 부각되며 긴축 기조 장기화에 대한 우려 나와.◇뉴욕증시, 반도체 관련주 약세…제약주 두각-11일(현지시간) 뉴욕증권거래소(NYSE)에서 엔비디아는 3.62% 큰 폭 하락. 자산운용가인 캐시우드의 매각과 모건스탠리가 인공지능(AI) 랠리 후반부에 위치했다는 보고서 발표 후 약세 지속.-AMD(-2.41%), 브로드컴(-1.56%), 마이크론(-1.64%) 등 반도체주도 동반 약세.-램리서치(-5.01%), AMAT(-4.0%) 등의 반도체 장비 업종은 미국의 대중국 투자 금지 등의 정책 여파로 하락.-테슬라도 캐시우드의 매도 소식과 중국 경기 위축 등이 복합적으로 작용하면서 1.1% 하락 마감.-일라이릴리는 비만 치료제에 대한 기대 심리가 지속되며 1.33% 상승.-머크(1.77%), J&J(0.98%) 등의 다른 제약주 역시 투자심리 개선으로 상승 마감.◇美 7월 생산자물가지수 0.3%↑…소비지수 견고 -미국 노동통계국에 따르면 7월 생산자물가지수는 전월 대비 0.3% 상승해 예상치(0.2%)를 상회. 전년 대비로는 0.8% 올라.-식품과 에너지를 제외한 수치는 전년 대비 2.4%를 유지했지만, 식품과 에너지, 무역서비스를 제외한 수치는 2.7% 기록.-7월 소비자 물가지수가 전월 대비 0.2%, 전년 대비 3.2% 상승에 그치며 물가 하락 전망에 무게가 실렸지만 소비자물가지수의 선행 역할을 하는 생산자물가지수가 재차 기대치를 웃돌면서 물가 하락 압력이 약해질 것으로 전망.-미국의 8월 소비심리지수는 71.2로 지난달(71.6)보다 둔화. 상황지수는 76.6에서 77.4로 개선됐지만, 기대지수는 68.3에서 67.3으로 위축. -1년 기대 인플레이션은 3.4%에서 3.3%로, 5년 기대 인플레이션은 3.0%에서 2.9%로 하락.◇국제유가, 수요 확대 전망에 상승 -11일(현지시간) 뉴욕상업거래소(NYMEX)에서 9월물 서부텍사스산원유(WTI)의 배럴당 가격은 전거래일 대비 0.45% 오른 83.19달러에 거래 마쳐.-런던ICE선물거래소에서 10월물 북해산 브렌트유는 전거래일 대비 0.47% 상승한 86.81달러로 마감.-국제유가는 세계에너지기구(IEA)가 원유시장 보고서에서 원유 수요가 하루 120만배럴에서 150만배럴로 늘어날 것으로 전망되면서 상승 .-사우디아라비아와 러시아의 자발적인 감산으로 공급이 축소되고 있는 점도 영향 미쳐. ◇中, 컨트리가든 디폴트 위기…채권 거래 중단-13일(현지시간) 사우스차이나모닝포스트(SCMP)는 중국의 대형 부동산 개발업체인 비구이위안(컨트리가든)의 채권 10종의 거래가 중단됐다고 보도.-이번 거래 정지는 컨트리가든의 채무불이행(디폴트) 위기가 제기된 영향으로 풀이돼.-컨트리가든은 지난 7월 만기인 액면가 10억달러 규모의 회사채 2종의 이자 2250만달러를 갚지 못하면서 주가가 급락.-컨트리가든은 채권자와 회의를 열고 앞으로 상환 계획에 대해 논의하고 투자자의 권리를 보호하기 위해 조처하겠다고 밝혀.◇김정은, 군수공장 시찰…“미사일 생산능력 제고”-조선중앙통신은 김정은 북한 국무위원장이 지난 11~12일 전술미사일 생산공장과 전술미사일 발사대차 생산공장 등을 현지지도했다고 14일 밝혀.-김 위원장의 군수공장 시찰은 지난 3~5일에 이어 엿새만.-김 위원장은 시찰 과정 중 미사일 생산능력을 비약적으로 제고함으로써 확대 강화된 전선부대들과 미사일 부대들의 편제 수요 및 작전 계획 수요에 맞게 생산장비를 확충해야 한다는 목표를 제시했다고 알려져.-김 위원장의 이 같은 행보는 한미연합연습 을지프리덤실드(UFS)를 앞두고 긴장을 고조시켜 도발 명분으로 삼으려는 것이 아니냐는 지적. ◇中, 외국인 투자유치 확대 추진…정부사업 참여 독려 -13일 중국 관영 신화통신에 따르면 중국 정부가 외자기업에 중국 국민과 동등한 대우를 보장하겠다는 내용의 ‘외국인 투자 환경 개선과 외국인 투자 유치 확대에 관한 의견’ 발표.-중국 국무원은 서비스업 확대 개방 종합 시범지역이 선도적인 역할을 하고, 동부 해안 지역에 몰린 외자기업의 중국 내 투자 지역을 내륙으로 단계적으로 넓히도록 유도하겠다는 방침.-아울러 국무원은 정부 조달 사업에 외자기업이 중국 구낸 기업과 동등하게 참여할 수 있는 환경을 조성하겠다는 지침도 밝혀.-외에도 금융 및 세제 지원을 강화해 중국 내 투자를 장려하겠다고 발표. ◇러 군함, 흑해 상선에 공격 사격…긴장 고조-13일(현지시간) 러시아 군함이 흑해를 가로질러 이동하던 팔라우 국적의 화물선에 경고 사격 실시.-러시아 국방부는 러시아 정찰용 군함인 바실리 비코프함이 흑해를 통해 우크라이나로 향하던 팔라우 화물선 ‘수크루 오칸’에 자동화기를 발사했다고 밝혀.-러 국방부는 화물선에서 금지품 운송 여부 검사를 위해 운항 정지를 요청했지만, 이를 응답하지 않았다고 설명.-앞서 흑해곡물협정 중단 이후 러시아는 우크라이나 항구로 출입하는 모든 선박을 ‘적대적 물자 운반 선박’으로 간주해 공격할 수 있다는 입장을 내놓은 바 있어.

- 日 소세이그룹, 스위스 아이도시아 한국 판권 인수 外 [지금 일본 바이오는]⑧
- 일본은 세계 3위 전통 제약 강국이다. 최근 5년 미국 FDA 승인 혁신 신약을 6개(한국 0개)나 개발했고 블록버스터 신약(매출 1조원)도 다수 보유하고 있다. 실제 일본 다케다의 유전성 혈관부종 치료제 ‘탁자이로’의 작년 매출은 1조원 이상이다. 반면 한국의 글로벌 블록버스터 신약은 아직 없다. 기술력 격차도 3년 정도 우리가 뒤처진다.기업 규모로 봐도 차이가 크다. 국내 대표 바이오 기업 셀트리온의 2022년 연결 기준 매출액은 2조 2839억원이지만 다케다의 매출은 37조 3756억원에 달한다. 격차가 12배 이상이다. 다만 일본이 케미칼(화학 기반) 의약품으로 성장했기 때문에 바이오 산업에선 승부가 결정나지 않았다는 의견도 있다. 일본도 아직 ‘바이오 대전환’은 이루지 못한 상황이다. 그렇다면 일본은 바이오 산업을 어떻게 키우고 있을까. ‘지금 일본 바이오는’이란 섹션을 통해 일본 제약바이오 산업에 대해 기획 연재해보고자 한다. [편집자주][이데일리 김승권 기자] 최근 3주간의 일본 제약바이오 소식을 한국어로 제공한다. 지난달 들려온 소세이그룹의 스위스 아이도시아 한국 및 아시아 판권 인수와 다이이찌산쿄의 연구개발 자회사 폐쇄 결정 등이 포함됐다.◇ 日 소세이그룹, 스위스 아이도시아 한국 판권 인수일본 소세이(Sosei) 그룹은 스위스 아이도시아의 한국 및 아시아 제품 판권을 지난달 획득했다. 매각 금액은 4억 스위스 프랑(한화 5900억원)이다. 소세이는 보유하고 있는 현금 400억엔과 은행 장기차입금으로 충당해 아이도시아의 한국법인과 일본법인의 전 주식을 취득키로 했다.이번 인수로 소세이그룹은 지난해 4월에 일본에서 발매된 뇌혈관 연축 억제약 ‘피브라즈’(PIVLAZ, 성분명 클라조센탄 나트륨)’과 불면증 치료약 ‘큐비빅(다리도렉산트) 등 아이도시아의 글로벌 파이프라인 중 최대 7품목에 대해 옵션권을 취득하게 됐다. 스위스 아이도시아와 일본 소세이헵타레스 로고다리도렉산트는 2022년 1월 10일, 수면에 진입하거나 수면상태를 유지하는 데 어려움을 겪는 불면증 환자를 위한 치료제로 미국 식품의약국(FDA) 승인을 받았다. 올 하반기 일본 승인도 기대된다.피브라즈는 엔도텔린A(endothelin A, ETA) 수용체 길항제로 뇌혈관경련(연축), 혈관경련 관련 뇌경색. 뇌동맥류 지주막하 출혈(after aneurysmal subarachnoid hemorrhage, aSAH) 후 뇌허혈 증상 예방 치료제로 알려졌다. 일본에서 승인 받은 건 2022년 1월이다. 특히 피브라즈는 2022년 일본에서 75억엔의 매출을 올렸으며, 올해는 130억엔의 매출이 예상된다. 미국에 이어 유럽에서 성인 불면증 환자의 치료제로 허가된 아이도시아의 큐비빅 제품소세이는 한국과 일본의 아이도시아 계열회사를 인수하는 등 아태지역 각국의 규제승인과 상업화를 주도하게 된다. 아이도시아 코리아는 22년 설립, 국내 규제 승인을 준비해왔으며 이번 판권계약으로 소세이가 국내 출시를 주도하게 됐다.이번 판권 매각은 아이도시아의 재정절감 대책의 일환으로 진행됐다. 판권 매각 직후인 지난달 21일 예상보다 낮은 제품 판매와 어려운 국제 금융 환경 등에 대응 연구개발 투자를 줄이는 한편 인력구조조정 계획을 발표한 바 있다.◇ 다이이치산쿄, 연구 개발 자회사 RD 노바레 폐쇄다이이치산쿄는 지난 8월 7일 연구개발 자회사인 다이이치산쿄 RD 노바레를 내년 3월 말까지 폐쇄하겠다고 발표했다. 연구개발 기능의 강화가 목적으로, RD 노바레의 기능은 다이이치 산쿄 본체로 이관한다. RD 노바레의 직원 수는 약 400명. 다이이치 산쿄의 창약·임상 개발 지원 업무를 하는 회사로서 2006년에 설립되었다. 다이이치산쿄는 “연구 개발 체제의 재편에 의해 연구개발의 새로운 생산성 향상을 도모해 나갈 것”이라고 했다.◇ 아스텔라스, 미국 매사추세츠 주에 신규 생명 과학 거점 개설아스텔라스 제약은 8월 10일 미국 매사추세츠주에 새로운 연구개발 거점을 개설한다고 발표했다. 24년 중에 현지 부동산 회사가 소유하는 생명과학 빌딩에 입주. 사무실 지역 외에도 미토콘드리아 관련 질환을 연구하는 마이트 브리지 부문의 연구 공간과 외부 파트너와 협업하는 인큐베이터 공간을 마련한다. 신 거점에는 현재 보스턴을 거점으로 하는 개발, 메디컬, 사업개발, 연구의 직원 수백명이 옮길 예정이다. 아스텔라스는 보스턴 주변 지역에서의 프레즌스를 높이는 동시에 혁신과 콜라보레이션 기회 창출을 목표로 한다. 이 회사는 20년에도 재생·세포 의료 분야의 연구 거점을 보스턴 교외에 설치하고 있다.◇ 소세이 경구암 면역요법제, P1/2a시험 개시소세이그룹은 8월 10일, 자사에서 발견한 경구암 면역요법 후보약 ’HTL0039732‘에 대해, 진행성 고형암을 대상으로 하는 임상 제1/2a상(P1/2a) 시험을 개시했다고 발표했다. 시험의 자금거출, 디자인, 실시는 영국 왕립암 연구기금이 담당하고 있다. HTL0039732는 프로스타글란딘 E2(PGE2)에 대한 수용체 중 하나인 EP4 수용체를 통한 신호전달을 억제하는 작용제이다. 암세포의 면역 회피를 활성화시키는 PGE2의 작용을 저해하고, 면역계가 암세포를 식별·억제하는 기능을 높이는 것으로, 마이크로 위성 안정성 대장암이나 위식도암 등에의 효과 기대된다.◇ 오츠카 자회사의 아스텍스, 머크와 제휴…암 억제 단백질에 대한 저분자약 창출오츠카 제약은 지난 8일 아스텍스 파머슈티컬즈가 미국 머크와 암 억제 단백질에 활성을 가지는 저분자 화합물 후보의 동정을 위한 독점적 연구 제휴·라이센스 계약을 맺었다고 발표했다 . 일본 주요 제약바이오 회사들(사진=유진투자증권)대상 지역은 전 세계. 아스텍스는 독자적인 기술을 사용하여 암 억제 단백질 p53의 여러 형태를 표적으로 하는 화합물을 개발하여 리드 화합물을 제공, 머크가 연구, 개발, 상업화를 진행한다. 계약의 대가로서 아스텍스는 일시금 3500만 달러(약 50억엔)와 개발·승인·판매 마일스톤으로서 1 프로그램당 약 5억 달러를 수령한다. 아스텍스와 미국 머크는 대호약품공업과 함께 2020년 암 영역에서 전략적 제휴를 맺고 있다.◇ 아스텔라스, 타가 CAR-T 세포 요법을 개발하는 포세이다와 제휴아스텔라스 제약은 8월 8일 미국 포세이다 세라퓨틱스와 암 영역의 세포 의료에 대한 전략적 투자를 포함한 제휴를 맺었다고 발표했다. 아스텔라스는 총 5000만 달러(약 72억엔)를 포세이다에 투자하여 주식의 약 8.8%를 취득함과 동시에 회사가 개발 중인 타가 CAR-T 세포요법 ’P-MUC1C-ALLO1‘의 독점 협상권을 획득, 이사회와 과학자문위원회에 옵서버로 참여할 권리와 포세이다 경영권 변경에 관한 일정한 권리도 취득한다. 포세이다는 독자적인 유전자 편집 플랫폼에서 암이나 희소 유전자 질환에 대한 세포 의료·유전자 치료를 개발하는 바이오 의약품 기업. P-MUC1C-ALLO1은 복수의 고형암을 대상으로 임상 제1상(P1) 시험을 실시하고 있다.◇ 아스테라스, ’IZERVAY‘ 승인아스텔라스 제약은 8월 5일 미국에서 지도상 위축(GA)을 동반한 노화황반변성 치료약 ’IZERVAY‘(일반명·avacincaptad pegol)의 승인을 취득했다고 발표했다. 이 약은 미국 아이베릭 바이오가 개발한 보체 C5 억제제의 핵산 의약. 아스텔라스는 7월 아이베릭을 인수했다. 2개의 피보탈 시험에서, 투여 후 12개월 시점에서 가짜 처리군에 비해 GA의 진행 속도를 통계적으로 유의하게 억제했다. 아스텔라스는 이 약의 대형화를 기대하고 있으며, 2027년경에 상정되는 항암제 ‘익스탄지’의 특허가 끝난 후 수익 감소를 보완하는 제품 중 하나로 자리매김하고 있다.
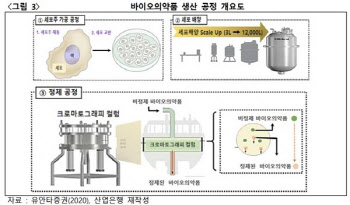
- [주목! e기술]눈여겨봐야 할 국내 바이오 소부장 기술
- [이데일리 송영두 기자] 바이오의약품 시장이 확대되면서 생산공정에 꼭 필요한 소부장 기술이 주목받고 있다. 특히 몇몇 기술은 국내 기업이 세계적인 수준을 보유하고 있다.바이오 소부장은 바이오 산업 연구개발 및 생산, 서비스 단계에 활용회는 소재, 부품, 장비를 총칭한다. KDB미래전략연구소 산업기술리서치센터 리포트에 따르면 바이오의약품에 대한 수요 증가로 인해 생산규모가 급격하게 증가돼 생산 공정에 필수적인 소부장 산업도 동반 성장하고 있다.세포배양배지 및 시약의 글로벌 시장 규모는 2019년 50억3200만 달러에서 2024년 74억4700만 달러로 확대될 것으로 전망된다. 일회용 백의 경우 2020년 18억6900만 달러에서 2028년 65억2900만 달러로 성장할 것으로 예측된다.하지만 바이오 소부장 시장은 글로벌 기업 5개사가 전체 시장 75% 이상을 독점하고 있다. 국내 바이오 기업들은 원부자재 90% 이상을 수입하고 있다. 장비 국산화율은 16%에 불과하다. 미국 머크 그룹은 약 25% 점유율로 1위 기업으로 손꼽히고, 미국 사이티바는 전략적 제휴 및 인수합병(M&A) 방식을 통한 전략으로 세계 2위 바이오 소부장 기업으로 성장했다.또 미국 다나허는 2015년 팔 코퍼레이션을 인수해 세계 3위 바이오 소부장 기업으로 도약했다. 독일 사토리우스도 주력 제품 고품질화를 통한 기업 확장 전략으로 바이오 소부장 시장 9.9%를 점유해 4위 기업으로 이름을 올리고 있다. 미국 써모피셔는 기업 M&A와 지속적인 신제품 출시로 경쟁력을 확보했고, 일본 아사히 카세이는 생물공정에 사용되는 바이러스 필터 제품군에서 독점적 지위를 확보하고 있다.(자료=KDB미래전략연구소 산업기술리서치센터)국내 바이오 소부장 기업들은 잘 알려져 있지 않고, 정부 지원이 부족한 실정이지만 일부 기업들은 세계적인 기술력을 자랑한다. 2015년 설립된 엑셀세라퓨틱스는 설립 직후부터 산업통상자원부, 중소벤처기업부, 한국보건산업진흥원 등 정부 기관으로부터 지원을 받았고, 설립 3년여 만에 세계 최초로 무혈청 화학조성 배양 배지 셀커(CellCor)를 개발했다.배지는 △1세대 우태아 혈청 △2세대 무혈청 배지 △3세대 화학조성 배지로 구분된다. 우태아 혈청은 소 태아 혈액을 이용한 배지로 제약·바이오 기업들이 가장 많이 사용하고 있다. 하지만 바이러스에 의한 감염 문제와 균질화 및 윤리적인 문제로 한계에 봉착했다는 분석이다. 무혈청 배지는 인간 혈소판 및 동물 유래 추출물을 사용한 배지로 우태아 혈청 배지 대비 안전성을 개선 시켰지만, 대량 수급 문제와 원료 추적 어려움이 단점이다. 반면 차세대 배지로 평가받는 화학조성 배지는 재조합 단백질을 활용해, 높은 안전성과 대량 수급 및 균질성을 유지할 수 있다. 셀커는 무혈청 배지 비교 실험결과 세포가 두배로 증식하는 시간이 셀커는 20~30시간으로 훨씬 짧은 것으로 나타나 월등한 증식력을 보여줬다. 증식 시간이 짧을수록 연구비용도 절감되는 만큼 큰 장점으로 꼽힌다. 현재 엑셀세라퓨틱스는 코스닥 시장 상장을 추진 중이며, 최근 기술성평가를 통과했다.마이크로디지탈(305090)은 국내 최초이자 유일하게 일회용 세포배양기 국산화에 성공했다. 국내 1호 바이오 소부장 기업이기도 한 이 회사는 일회용 세포배양기 셀빅을 2020년 론칭했다. 해당 제품은 세계 최초 Free Rocking 방식(Rocking + Orbital)을 활용한 바이오리액터로 기존 경쟁제품들의 단점은 배제하고 장점을 극대화한 장비다. 써모피셔, 사이티바, 싸토리우스 등의 세포배양기는 믹싱 시스템이 제한적이다. 반면 셀빅은 좌우, 상하, 대각선으로 움직이는 자유로운 믹싱시스템을 구현해 1000ℓ급 대용량까지 생산이 가능하다. 또 배양기(Bag) 내에 임펠러가 없어 세포가 자라나기에 최적의 환경을 구현했다. 가격도 글로벌 제품 대비 70% 수준으로 경쟁력이 높다는 평가다. 다만 세계적인 기술을 확보했음에도 국내 기업들은 외국산 장비 선호도가 높다. 따라서 국내 기업 제품을 활용하게 하는 정부의 정책적 지원이 필요하다는 지적이다. 업계는 정부가 나서 국산 제품 개발에 연구개발비를 지원하고, 국산 제품 사용 기업에 인센티브를 주는 직접적인 지원 등의 방안을 제시하고 있다.
- [미래기술25]①mRNA 코로나19를 넘어, 질병방어 ‘구원투수’로
- “고난은 발전의 밑거름이다.”미국의 사상가 겸 시인 랄프 왈도 에머슨은 이렇게 말했습니다. 이를 여실히 보여주는 것이 2020년 ‘코로나19 팬데믹’(대유행)입니다. 역설적이게도 인류의 비극은 신약 개발 기술을 비약적으로 발전시켰습니다. 통상 신약개발에 드는 시간은 10년. 하지만 글로벌 제약사들은 단 11개월 만에 코로나19 백신을 개발하며 과학기술과 백신의 역사를 새로 썼습니다.가장 주목받는 것은 메신저 리보핵산(mRNA) 백신입니다. mRNA 백신은 세계에서 처음으로 발명됐음에도 예방효능 90% 이상을 자랑하며 팬데믹을 잠재우는 데 큰 공을 세웠습니다. mRNA 백신을 개발한 모더나와 바이오엔테크가 단숨에 세계적인 바이오 회사로 발돋움한 데도 mRNA 백신의 힘이 컸습니다. 코로나19 변이바이러스가 끝없이 나오는 상황에서 거의 유일하게 대안으로 떠오르는 백신은 mRNA밖에 없습니다. 우리나라도 mRNA 기술을 하루빨리 확보해야 하는 이유입니다.[이데일리 유진희 기자] 코로나19 사태의 돌파구를 만들었던 mRNA 백신이 또 다른 인류 난제 해결을 위해 무대를 이동하고 있습니다. 암, 심혈관과 자가면역 질환 등 인류가 완전히 극복하지 못한 질병들의 해결사를 자처하는 분위기입니다. 선봉장으로는 코로나19 mRNA 백신을 처음으로 개발한 미국의 생명공학기업 모더나가 나섰습니다. (사진=게티이미지)◇모더나 창업자 랭거 “맞춤형 백신 가능”모더나는 모든 질병에 대한 맞춤형 mRNA 백신을 2030년까지 내놓을 계획입니다. 모더나의 창업자 로버트 랭거 미국 매사추세츠공대(MIT) 석좌교수는 지난 4월 제주 국제컨벤션센터(ICC)에서 열린 한국생물공학회 ‘춘계학술발표대회 및 국제심포지엄’ 온라인 기조강연에서 “mRNA 기술로 암 환자를 위한 맞춤형 백신도 만들 수 있다”고 직접 밝히기도 했습니다. 그는 20년 이상 나노 과학을 연구한 관련 분야 세계 일인자입니다. 이미 성과도 나오고 있습니다. 일례로 모더나가 최근 공개한 흑색종 mRNA 백신 임상에 따르면 mRNA 암 백신과 미국 머크의 면역항암제 키트루다를 병용한 환자군은 단독 사용한 환자군보다 피부암 재발이나 사망이 44%나 낮았습니다. 당시 랭거 교수는 “코로나19 백신을 개발할 때도 유전체 정보가 나오고, 한 달 만에 테스트 백신이 개발됐다”며 “개발 속도가 빠른 mRNA 백신은 감염병과 환자 맞춤형 치료제 개발에 상당히 유용할 것”이라고 전했습니다. 모더나의 자신감은 코로나19를 통한 성공 경험에서 비롯됩니다. mRNA 코로나19 백신은 변방의 바이오벤처 모더나를 단숨에 글로벌 기업으로 탈바꿈시켰습니다. 실적이 말해주고 있습니다. 모더나는 코로나19 백신 접종이 시작된 2020년 8억달러(약 1조원)로 시작으로 2021년 185억달러(약 24조원), 2022년 193억달러(약 25조원)의 매출액을 각각 올렸습니다.이재용 삼성전자 부회장(왼쪽)이 2021년 11월 16일(현지시간) 미국 매사추세츠주 캠브리지에서 누바 아페얀 모더나 공동 설립자 겸 이사회 의장을 만나 기념 촬영하고 있다. (사진=삼성전자) ◇코로나19 해결 주역 mRNA 백신..‘기적’ 아닌 ‘필연’이를 기적과 같은 일이라고 평가하는 사람도 있습니다. 하지만 mRNA 역사와 특장점을 이해한다면 오히려 ‘왜 더 빨리 mRNA 백신이 상용화되지 못했을까’라는 반문을 하게 될 것입니다. 답을 찾기 위해서는 백신의 역사를 언급하지 않을 수 없습니다. 과거에는 백신에 진짜 바이러스를 사용했습니다. 바이러스를 가열하거나 화학물질 처리해서 병원성을 잃게 만든 다음 몸에 집어넣어 항체를 형성하는 방식이었습니다. 수두, 장염, 홍역, 장티푸스 백신이 대표적입니다. 이 같은 백신은 예방효능이 좋지만, 균 자체를 주입하기 때문에 바이러스의 병원성이 살아 있을 수 있습니다. 제조 기간이 길며 장기간 보관도 쉽지 않습니다. mRNA 백신은 바이러스 유전정보를 담은 백신입니다. 덕분에 기존 백신과 같은 단점이 없습니다. 코로나19 mRNA 백신을 예로 들어보겠습니다. 코로나19 mRNA 백신은 코로나19의 유전정보만을 이용해 체내에서 이와 유사한 단백질을 만들도록 합니다. 병원성에 감염될 우려도 없고 게놈 DNA 삽입에 의한 돌연변이 유발 위험도 적습니다. 정상적인 세포 대사 과정을 통해 분해되기 때문에 체내 반감기(효능이 줄어드는 기간)를 조절할 수도 있습니다. 재료인 뉴클레오사이드를 조금만 변형하면 안정성과 단백질 합성과정의 효율을 증가시킬 수도 있습니다. (사진=게티이미지)◇LNP로 mRNA 백신 단점 보완..유통 문제 등 과제도1961년 최초로 발견된 mRNA가 이 같은 장점에도 2020년에서야 비로소 백신으로 역할을 했습니다. 일부 문제점도 있었기 때문입니다. 우리 몸이 mRNA를 침입자로 인식해 공격하고, 그 과정에서 과도한 면역반응 부작용이 발생했습니다. 체내 효소로부터 잘 분해되는 특성 때문에 세포 안으로 주입해 효능을 발휘하게 하는 것도 어려운 일이었습니다. 동물실험 결과 mRNA 분자 1만 개당 1개 정도(0.01%)만 전달되는 데 그쳤습니다.첫 번째 과제는 1970년대부터 mRNA를 지속해 연구해왔던 카탈린 카리코 펜실베이니아대 교수가 해결했습니다. 2005년 mRNA 염기서열 중 하나인 유리딘을 메틸수도유리딘으로 바꿔 면역반응을 일으키지 않는 mRNA를 합성할 수 있음을 밝힌 겁니다. 2014년에는 mRNA 염기 서열 엔지니어링을 통해 단백질 합성 과정의 효율을 크게 증가시킬 수 있는 기술도 개발했습니다.두 번째 과제는 랭거 교수가 해답을 내놨습니다. 그는 인지질(이온화 인지질·ionizable lipid), 콜레스테롤, 폴리에틸렌글리콜(PEG)로 만든 지질나노입자(LNP·lipid nanoparticle)가 mRNA를 세포 안까지 안전하게 전달할 수 있다는 점을 발견했습니다. mRNA 백신이 코로나19 사태에서 큰 역할을 할 수 있게 된 요인입니다. 그럼에도 활용도가 더 높아지려면 극복해야 할 점이 존재합니다. 상용화된 mRNA 백신은 모두 LNP를 약물전달체로 사용합니다. LNP를 더 안정된 상태로 만들기 위해 들어가는 PEG 때문에 심각한 전신 알레르기 증상인 ‘아나필락시스’ 부작용이 있습니다. 또 LNP는 구조가 불안정해 초저온에서 보관해야만 합니다. 화이자·바이오엔테크 mRNA 백신의 경우 영하 70도 상태에서 유통해야 하고 모더나 백신 역시 영하 20도에 보관해야 합니다. 접종 과정에서는 드물지만 심근염·심낭염 발생이 보고되고 있습니다. (사진=게티이미지)◇mRNA 백신 성공 의구심 사라져..2027년 시장 규모 170조하지만 이제 mRNA 백신의 성공 가능성에 대한 의구심은 확실히 걷혔습니다. 가파른 시장의 성장이 이를 방증합니다. 시장조사업체 글로벌 인더스트리 아날리스트(GIA)는 mRNA 백신 시장 규모는 2021년 649억달러(약 85조원)에서 연평균 11.9% 성장해 오는 2027년에는 1273억달러(약 167조원)에 이를 것으로 내다봤습니다. 시장을 선점하기 위한 노력에 아군과 적군의 경계도 사라졌습니다. 미국과 중국의 갈등 고조에도 모더나는 중국 상하이시와 약 10억달러(약 1조3000억원) 규모 현지 투자 계약을 체결하기로 했습니다. 앞서 모더나는 지난 5월 상하이에 ‘모더나 (중국) 바이오테크 유한회사’ 법인을 등록하면서 중국 시장 진출을 위한 예비 단계라고 설명하기도 했죠. 이는 모더나가 중국 본토에 설립한 첫 법인입니다. 지난해엔 홍콩에 사무실을 열었습니다. 당시 모더나 대변인은 로이터통신에 “모더나의 mRNA 플랫폼이 가진 힘을 중국인들에게 가져다줄 기회를 모색하고 있다”고 전했습니다. 세계적인 기업가들도 mRNA 백신의 새로운 도전을 응원하고 있습니다. 지난 6월 중국을 방문한 빌 게이츠 마이크로소프트(MS) 공동창업자는 현지 mRNA 연구 선도기관인 베이징 소재 글로벌의약품연구개발센터(GHDDI)에서 연설한 뒤 5년간 5000만달러(약 654억원)를 GHDDI에 기부하겠다고 약속했습니다. 그는 mRNA 기술이 코로나19 이외에도 결핵과 말라리아 같은 질병에도 유용하다면서 중국 GHDDI의 분발을 촉구했습니다.mRNA 백신 개발업체 아이진(185490) 유원일 대표는 “이미 mRNA 백신에 대한 연구는 암뿐만 아니라 인플루엔자, 지카바이러스, 말라리아 등 다양한 부문에서 이뤄지고 있다”며 “이제 막 시장이 열린 만큼 기업이 적극 나서고 정부도 지원한다면 우리의 역할도 찾을 수 있을 것”이라고 강조했습니다.

- [엔케이맥스 대해부]②불치병 완치하고 알츠하이머도 효과
- [이데일리 김지완 기자] 엔케이맥스(182400)의 자연살해(NK)세포 치료제 ‘수퍼NK’가 불치병으로 불리던 질환에서 치료 효과를 내면서 기업 가치가 재평가되고 있다.유럽종양학회(ESMO) 2022 포스터에 공개된 엔케이맥스 NJ세포치료제 ‘SNK’와 머크 키트루다 병용투여에서 34개월 간 완전관해(CR)을 유지하고 있는 환자 보고서. (제공=ESMO)2일 관련 제약·바이오업계에 따르면 엔케이맥스는 수퍼NK를 기반으로 불응성 비소세포폐암, 육종암, 알츠하이머 등 고형암에서부터 신경퇴행성 질환까지 5종 적응증을 타깃으로 하는 임상 파이프라인을 보유 중이다.엔케이맥스는 2002년 설립된 NK세포 기반 면역세포치료제 개발 바이오기업이다. 선천면역 세포인 NK세포는 체내에 약 5~15%로 아주 적게 존재해 치료제로 사용하기엔 수가 적다. 엔케이맥스는 차별화된 기술로 NK세포를 대량생산하고 활성도를 높였고 이를 수퍼NK로 명명했다. ◇ 육종암 환자, 43개월째 재발 없어현재까지 성과만 놓고 보면 엔케이맥스는 킴리아·예스카다 등의 CAR-T 치료제를 뛰어넘을 만한 잠재력을 가졌다는 평가다. 자사 NK세포치료제 ‘SNK’와 키트루다 병용투여로 완전관해(CR) 판정을 받은 미국인 32세 육종암 환자가 43개월째 암이 재발하지 않고 있다. 이 기간 해당 환자는 총 47차례 ‘SNK+키트루다’를 투약했다. 이 환자는 지난 2017년 전이성 육종암 진단을 받았다. 암세포는 복부·골반 림프절 및 간에 광범위하게 전이돼 있었다. PD-L1 음성으로 키트루다·옵디보 같은 면역항암제도 전혀 듣지 않았다. 이 환자는 SNK+키트루다 처방 전 5차례에 걸쳐 다른 약물을 투약했으나 모두 실패로 돌아갔다. 구체적으로 1차 닥서루비신·사이탁산·빙크리스틴, 2차 이타퍼사이드·이포스파미드, 3차 알독소루비신·이포스파미드, 4차 아이리노테칸·빙크리스틴·테모달, 5차 얀델리스·키트루다 순이다. 엔케이맥스 관계자는 “이 환자는 더 이상 쓸 약이 없던 상황”이라면서 “미국 현지 의사가 FDA(식품의약국)에 치료목적으로 ‘SNK+키트루다’ 동정적 사용 승인을 받아 투약한 것”이라고 설명했다. 이어 “이 환자 몸 전체 퍼진 암세포가 ‘SNK+키트루다’ 16차례 투약 후 말끔이 사라졌다”면서 “이후 주기적으로 투약을 이어가고 있고 3년간 완전관해를 유지하고 있다”고 강조했다.이번에 FDA에 동적적 사용승인을 신청한 의사는 현재 미국 육종암센터에 근무 중으로 키트루다·바벤시오와 SNK 병용투여 미국 임상 1상에 참여 중이다. 이 의사는 SNK 병용투여 임상에서의 좋은 결과를 목격하고 임상과 별개로 사망 직전의 8명의 환자를 FDA에 등록하고 투약을 결정했다.주목할 점은 지금껏 개발된 치료제 가운데 고형암에서 이 같은 효능을 보여준 전례가 없다는 것이다. 특히 이 암 환자는 모든 치료제에 불응했고 사망 직전의 상태였다. 하지만 엔케이맥스의 NK세포치료제를 투약하고 기사회생했다. 높은 효능으로 주목받고 있는 CAR-T는 적응증이 혈액암에 국한돼 있다. 전체 암에서 고형암이 95%를 차지하고 혈액암 비율은 5%에 불과하다. 엔케이맥스는 지난해 육종암 임상 1상 병용투여군 15명의 중간 데이터를 발표했다. 구체적으로 완전관해(CR)1명, 부분관해(PR) 1명, 안정병변(SD) 8명을 각각 기록했다. 엔케이맥스는 현재 육종암 임상 1상을 마무리하고 최종 결과 분석 중이다.알츠하이머협회 국제회의(AAIC 2023)에서 폴송 엔케이젠바이오텍(미국법인) 대표이사가 발표 중이다.(제공=엔케이맥스)◇ 알츠하이머에도 치료 효과멕시코에서 진행된 10명의 알츠하이머 환자에 대한 수퍼NK 임상 중간 1상 결과에서 7명의 환자로부터 인지력 개선이 확인됐다. 특히 마지막 투약 후 12주 뒤에도 개선된 인지력이 유지됐다. 엔케이맥스는 이 같은 결과를 지난달 네달란드 암스테르담에서 열린 ‘알츠하이머협회 국제회의’(AAIC 2023)에서 발표했다.엔케이맥스 관계자는 “3가지 인지력측정 지표에서 적게는 5명, 많게는 7명까지 인지력이 개선됐다”며 “수퍼NK 투약 후 뇌척수액의 바이오마커와 신경염증의 개선이 보였다”고 말했다.이어 “약 70% 알츠하이머 환자가 용량 증가에 따라 인지능력 개선 및 안정화 효과가 유지되는 경향을 보였다”면서 “수퍼NK가 저용량에서도 충분히 효과적인 알츠하이머 치료제다. 고용량 치료 시 더욱 긍정적인 장기 치료결과를 기대할 수 있는 의미”라고 강조했다.미국 식품의약국(FDA)는 올해 1월 수퍼NK를 알츠하이머 환자를 대상으로 동정적 사용승인을 했다. 동정적 사용승인은 의사가 자신의 환자 치료를 목적으로 임상 중인 약물에 대해 FDA에 사용허가를 얻는 절차다. 대게 동정적 사용 승인은 더이상 사용 가능한 치료제가 없어 치료를 포기할 상황에 이를 경우 의사 판단 아래 이뤄지는 절차다.알츠하이머·파키슨병은 지금까지 증상완화제는 있어도 치료제는 없었다. 하지만 수퍼NK는 난공불락으로 여겨지던 질환들에서 약 효능을 입증하고 있는 것이다.한편 엔케이맥스는 미국과 한국에 cGMP(FDA 인증 우수의약품 관리 및 제조) 시설을 보유하고 있어 임상에 필요한 수퍼NK를 자체적으로 생산할 수 있다. 엔케이맥스는 자가·동종 NK세포 모두 8만~40만 도즈 이상 대량 생산이 가능하다.

- 배규운 애니머스큐어 대표 “‘근육량·근력·근기능’ 삼박자 개선, 근감소증 최초 신약 자신”
- [이데일리 김진호 기자] “노화로 인한 근감소증 치료제로 효능을 발휘하려면 근육량과 근력, 근기능 등을 동시에 개선해야 한다. 20여 년 간 연구 결과 이들 세 가지에 모두 영향을 주는 유전자와 그 작용 생체 기전을 규명했다. 여기에 영향을 줄 수 있는 후보물질을 발굴해 임상 2상을 준비하고 있다. 글로벌 시장을 무대로 할 ‘퍼스트 인 클래스’ 근감소증 신약으로 개발해 나가겠다.” 4일 이데일리와 만난 배규운 애니머스큐어 대표는 “미국 리제네론 파마슈티컬스(리제네론)나 머크(MSD) 등 글로벌 제약사(빅파마)가 발굴했던 근감소증 신약 후보물질들도 임상 2상에서 제대로 된 치료 효능을 입증하지 못했다. 그들의 약물이 단순히 근육량을 높이는 수준에 그쳤기 때문이다”며 이같이 말했다.배규운 애니머스큐어 대표가 회사의 신약 후보물질의 특징과 개발 전략 등을 설명하고 있다.(제공=김진호 기자)지난해 파머스바이오와 합병한 애니머스큐어는 노화성 근감소증및 악액질 등 근육질환 신약개발 전문 기업으로 알려졌다. 파머스바이오는 2021년 숙명여대 약대 교수인 배 대표가, 애니머스큐어는 2020년 성균관대 의대에 재직 중인 강종순 대표가 각각 설립했다. 두 사람이 합심해 합병한 회사명을 애니머스큐어로 결정했고, 현재 회사의 공동대표를 맡고 있다.배 대표는 “2004년부터 강 대표와 공동연구를 수행해왔다. 근육 관련 신약개발 부문 연구 성과는 애니머스큐어를 통해, 천연물 소재 부문 성과는 파머스바이오를 통해 사업화를 시도했다가 지난해 완전히 합치게 됐다”며 “근육개선용 천연물 소재도 확보했지만, 관련 신약개발에 총력을 기울이고 있다” 운을 뗐다. 그는 이어 “근육 줄기세포 분화와 생성 등에 대한 폭넓은 연구과 그 핵심 유전자를 발견한 논문으로 주목받았다”며 “이를 바탕으로 근육 감소와 관련된 질환을 타깃하는 데 핵심적 역할을 할 수 있는 물질을 두루 찾아낼 수 있었다”고 설명했다. 실제로 배 대표와 강 대표는 근육 줄기세포의 생성과 분화 등에서 각각 84편과 101편의 논문에 이름을 올렸다. 여기에는 근육 생성을 방해하는 ‘마이오스타틴’ 억제 부터 근육 재생과 관련된 생체기전에 작용하는 핵심유전자 ‘CDO’, 근력 향상을 위한 에너지 대사를 향상시키는 ‘PGC1a’까지 근감소증 개선 관련 핵심 물질과 그 세부 생체 기전 등에 대한 내용이 다수 포함됐다. 애니머스큐어는 미국이나 유럽, 일본 등 주요국에서 이와 같은 연구결과에 근거한 5건의 원천기술의 특허 등록을 마쳤고, 적응증 및 용도 특허 25건도 출원한 바 있다. 회사는 화합물 수천여 종을 재분석해 자사의 원천 특허 내용에 따라 근육량 및 근력, 근기능 등을 동시에 개선하는 물질을 찾았고, 결국 현재까지 7종의 주요 후보물질을 확보하는데 성공했다.애니머스큐어가 내세우는 주력 후보물질로는 △노화성 근감소증 대상 ‘AMC6156’(임상 2a상 준비) △악액질 대상 ‘AMC6133’(임상 2a상 준비), △대사성 근감소증 및 뒤센 근이영양증(DMD) 대상 ‘AMC9005’(전임상) 등 3종이 꼽힌다. 이중 AMC6156과 AMC6133은 기존의 허가된 약물의 적응증을 각각 노화성 근감소증과 악액질 등으로 재창출하려는 상황이다. 애니머스큐어는 이들 2종에 대해 임상 1상 없이 2a상으로 진입한다는 계획을 진행하고 있다.배 대표는 “AMC6156은 이미 시판된 ‘비스테로이드성 항염증제’(NASID) 계열의 약물이며, 적응증을 재창출하려고 한다”며 “해당 물질은 특허가 없고, 용량을 적게 낮추면 부작용도 이슈도 문제가 되지 않는다”고 운을 뗐다. 이어 “이 물질이 우리가 밝혀낸 CDO, PGC1a 등의 기전에 작용하며, 실제 동물실험에서 근육 재생, 미토콘드리아 내 에너지 대사 증가로 근력 강화, 마이오스타틴 억제를 통한 근육생성량 증가 등 근감소증 치료제의 효능을 고루 갖춘 것으로 분석됐다”고 설명했다애니머스큐어는 연내 AMC6156의 국내 임상 2a상을 진입해, 내년까지 완료하는 것을 목표로 하고 있다. 이후 해당 물질의 임상 2b상부터는 호주 임상시험수탁기관(CRO) ‘노보텍’과 함께 기술수출 등을 통해 글로벌 개발 시도를 이어간다는 전략을 수립 중이다.이밖에도 회사는 암이나 당뇨병 등의 질환으로 인해 근손실과 그 기능이 저하되는 질환인 악액질 대상 신약 후보 ‘AMC6156’의 임상 2a상도 2025년까지 완료하는 것을 계획하고 있다. AMC9005의 경우 같은 시기까지 대사성 근감소증 적응증의 임상 1상 완료 및 뒤센근이영양증 적응증 관련 희귀의약품(ODD) 지정 등을 달성하는 것을 고려하고 있는 상황이다.애니머스큐어 주요 후보물질 개발 현황(제공=애니머스큐어)한편 애니머스큐어는 설립후부터 현재까지 엔젤 투자와 정부지원금 등을 포함해 약 40~50억원의 투자금을 유치했다. 배 대표는 “이번 달부터 2~3달간 시리즈 A를 오픈했다”며 “AMC6156과 AMC9005 등 주요 후보물질의 임상 진전을 위해 65억원 정도의 펀딩(투자금 유치)을 확보하는 것을 염두에 두고 있다”고 말했다.그에 따르면 글로벌 근감소증 치료제 시장은 2030년경 47억 달러(한화 약 6조1500억원), 악액질 시장은 2029년경 31억 달러(한화 약 4조원)로 형성될 것으로 전망되고 있다.배 대표는 “근육 관련 질환은 일정 비율의 인구에서 필연적으로 발생하며, 기대수명이 늘면서 그 예측 규모가 꾸준히 증가하고 있다”며 “우리 물질이 타깃하는 기전의 가능성은 여러 논문을 통해 학계에서 입증됐다. 임상에서 그 효능을 검증해 글로벌 시장을 누빌 수 있는 최초의 신약 개발을 완수하기 위해 노력하겠다”고 말했다.

- [류성의 제약국부론] '기울어진 운동장'과 2백년 제약 서구패권
- [이데일리 류성 바이오플랫폼센터장] 1760년대부터 영국에서 시작된 산업혁명은 세계를 서구 중심의 자본주의로 재편하는 결과를 가져왔다. 지금도 큰 틀은 그대로 유지되고 있다고 볼수 있다.산업혁명 이후 주요 글로벌 제조산업인 자동차, 조선, 반도체, 철강, 전자제품등은 얼마 전까지 모두 미국, 유럽 등 서구 자본주의 국가의 기업들이 쥐락펴락하면서 사실상 패권을 장악해 왔다. 하지만 시간이 흐르면서 일본을 선두로 한국, 중국 등이 잇달아 이들 산업의 신흥 패자로 자리매김하면서 서구 독식시대의 종말을 예고하고 있는 형국이다. 세계 주요 산업의 패권이 서구에서 주로 아시아로 중심축이 옮겨지고 있지만, 유독 수백년간 꿈쩍하지 않고 서구 자본주의가 굳건하게 패자로서 군림하는 분야가 남아 있어 주목된다. 바로 제약산업이다. 글로벌 제약산업은 시장규모가 2021년 기준 1826조원(피치솔루션스)에 달할 정도로 다른 어느 산업보다도 압도적으로 큰 덩치를 자랑한다.1668년 설립된 세계에서 가장 오래된 제약사인 독일 머크의 본사 전경. 홈페이지 갈무리실제 매출 기준 글로벌 상위 10대 제약사 면면을 보더라도 모두 예외없이 서방 선진국 기업들이다. 화이자, 존슨앤존슨, 로슈, 머크, 애브비, 노바티스, BMS, 사노피, 아스트라제네카, GSK 등이 그들이다. 아시아 기업은 전무하다. 독일의 머크 등 유럽 제약회사들이 본격적으로 등장하기 시작한 것은 1800년대 중반이다. 그 이후 유럽과 미국 제약회사들이 글로벌 제약산업을 지속적으로 장악해 왔다. 서방 선진국들의 제약산업 패권은 300년 가까이 이어지고 있는 셈이다.서양의학을 근간으로 글로벌 제약산업이 탄생, 성장해온 것이 선발주자인 서방 선진국 기업들이 패권을 지속적으로 장악할수 있게 해준 결정적인 비결일 것이다. 여기에 글로벌 블록버스터 신약하나 만들려면 십수년에 걸쳐, 수조원에 달하는 연구개발비를 투입해야 하는 까다로운 업의 특성도 한국을 비롯한 후발주자들의 도전정신을 눌러오면서 선발주자들의 장기독주체제를 가능하게 했다.하지만 유럽, 미국 중심의 제약산업 장기패권을 가능하게 만들고 있는 치명적인 패착은 업계에 만연해 있는 ‘라이언스 아웃’(기술 수출) 기업 문화이다. 글로벌 제약사들은 시장 잠재력이 크고, 신약 상용화 가능성이 높은 신약후보들을 입도선매 식으로 경쟁적으로 사들이고 있는 추세다. K바이오를 포함한 후발주자들은 자체적으로 신약물질을 상용화할수 있는 역량과 자금력이 부족하다보니 기술수출에 사활을 걸고있는게 현실이다.그러다보니 글로벌 제약사들은 세계 곳곳에서 후발주자들이 어떤 신약물질을 개발하고 있는지를 현미경으로 들여다보듯이 세밀하게 파악하고 있다. 이들이 엄선해 기술수입한 신약물질은 당연히 상용화 가능성이 높고, 그 결과 신약 연구개발 및 상용화의 결실 대부분을 독식하게 되는 구조다.요컨데 신약 기술 도입을 둘러싸고 글로벌 제약사들에게 일방적으로 유리하게 짜인 ‘기울어진 운동장’을 바로잡지 않으면 미국, 유럽 중심의 제약패권은 당분간 지속될수 밖에 없다. 그러려면 무엇보다 매출이 조단위를 넘어설수 있는 글로벌 블록버스터 신약후보를 글로벌 제약사들에 지금처럼 기술수출하지 않고, 자체 상용화까지 이어지게 할수 있는 산업 생태계 구축이 절실하다. 이 생태계가 이뤄지지 않으면 제약강국은 언감생심일뿐 아니라 서방선진국의 제약패권은 앞으로 더욱 공고해지게 될 것이다.

- [비엘 대해부]①우수 인재 곳곳 포진...'신약 개발부터 상업화까지 경험'
- [이데일리 김지완 기자] 비엘(142760)의 최대 강점은 우수한 맨파워다.이도영 비엘 연구개발본부장(상무, 이학박사)가 폴리글루감마탐산 치료제 특성에 대해 설명 중이다. (사진=김지완 기자)우선 임상개발센터장을 맡고있는 이도영 상무(이학박사)는 종근당 재직시절 국산신약 20호 듀비에정 화학구조를 디자인했다. 이후 크리스탈노믹스로 자리를 옮겨 국산신약22호 아셀렉스캡슐 허가와 약가협상을 담당했다. 이 상무는 국내에서 신약 개발을 처음부터 끝까지 경험해 본 몇 안 되는 인물로 꼽힌다. 특히, 국산신약 36개 가운데 2개가 이 상무 손을 거쳤다. 더 놀라운 건 크리스탈노믹스의 분자표적 항암제 ‘CG200745’는 임상 2상 직후 식품의약품안전처(식약처)로부터 희귀의약품으로 지정됐다. 희귀의약품은 대체 의약품이 없어 긴급하게 도입할 필요가 있는 의약품을 뜻한다. 희귀의약품으로 지정되면 임상시험 2상까지만 마쳐도 판매허가를 먼저 받는다. ‘CG200745’을 췌장암, 골수이형성 증후군 등을 적응증으로 임상 2상을 진행한 사람이 바로 이 상무다. 그는 지난 2020년부터 비엘에서 청국장 유래 물질 폴리감마글루탐산을 이용해 항암제를 개발 중이다. 무디 세브스 이스라엘 와이즈만 연구소 유기화학과 석좌교수가 지난해 5월 서울 종로구 인사동 오라카이 스위츠 호텔에서 이데일리와 단독 인터뷰 중이다. (사진=김지완 기자)비엘은 무디 세브스’(Mudi Sheves) 이스라엘 와이즈만 연구소 유기화학과 석좌교수를 든든한 조력자를 두고 있다. 그는 1981년부터 와이즈만 연구소에서 교수로 재직했다. 와이즈만 연구소는 1934년에 설립된 세계 5대 기초과학 연구소다. 특히 지난 2006년부터 2019년까지 와이즈만 연구소 부총장으로 역임했다. 이 기간 산하 기술지주회사 ‘예다’ 이사장을 겸임하면서 와이즈만의 기술수출을 진두지휘했다. 애브비의 휴미라, 테바의 코팍손, 머크의 얼비툭스 등이 모두 그의 손을 거쳐 탄생했다. 이들 치료제는 와이즈만 연구소에서 개발돼 기술수출을 거쳐, 글로벌 블록버스터 치료제로 등극했다.와이즈만 연구소는 모두가 실패한 p53 항암제 후보물질 개발에 성공했다. p53 유전자는 스트레스, DNA 손상, 저산소증, 종양(암) 발생에 대한 세포 반응을 조절한다. p53이 암세포 진행을 막는 세포통제 사령관 역할을 한다고 볼 수 있다. 이 치료제는 지난 2018년 비엘과 와이즈만의 이스라엘 합작법인 퀸트리젠에 기술이전됐다. p53 치료제는 지난해 동물실험을 마무리하고 한국과 미국에서 임상 1상을 앞두고 있다. 무디 교수는 비엘의 p53의 임상 성공과 상업화를 위해 물심양면 지원을 아끼지 않고 있다.오르나 팔기(Orna Palgi) 박사는 1996년 와이즈만연구소에서 면역학부로 박사학위를 취득했다. 그는 지난 2003년부터 다국적 제약사 ‘테바’(TEVA Pharmaceutical)에서 글로벌 CMC와 바이오의약품 개발 분야 리더, 다발성 경화증 및 자가면역 치료 연구개발 프로젝트 리더, 글로벌 R&D 실사 및 평가 본부장을 거쳤다. 팔기 박사는 미국과 유럽 임상 규제기관을 담당하며 임상 3상까지 신약개발 전체를 경험했다. 이후 미국 제약사 ‘오틱 파마’(Otic Pharma)의 최고운영책임자(COO)로 재직하며 오틱파마를 나스닥 상장사 ‘노뷰스’(NOVUS Therapeutics)와 인수합병을 주도했다. 이스라엘 신약 개발업체 ‘리제네라 파마’(Regenera Pharma) 연구개발 수석부사장을 역임하며 비동맥 허혈성 시신경병증 치료제 미국 FDA 임상 3상을 담당했다.김태완 비엘멜라니스 이사회 의장 겸 미국 컬럼비아대 의과대학 교수. (제공=비엘멜라니스)김태완 비엘멜라니스 이사회 의장 겸 미국 컬럼비아대 의과대학 교수도 비엘의 맨파워에서 빠질 수 없는 인물이다. 기존 MRI 간조영제가 간섬유화까지 살펴볼 수 없다. 더욱이 MRI 간 조영제 주 성분인 가둘리늄이라는 맹독성 중금속 성분은 몸 밖으로 배출되지 않고 인체 여타 장기에 흘러들어가면 염증반응, 전신섬유화, 뇌침전 등의 부작용을 일으킨 여러 문제를 유발한다. 이런 상황에서 김 교수는 인체 멜라닌을 모사해 혁신적인 간 조영제를 개발했다. 이 조영제는 독성은 없고 간암은 물론 간 섬유화까지 정확하게 살펴볼 수 있다. 비엘의 고문 겸 기술연소 이사를 역임 중인 함경수 박사도 중요 인물 중 하나다. 그는 하버드대학교 의과대 암센터 연구원을 거쳐 조선대 의과대 석좌교수를 역임했다. 20여년 이상 펩타이드를 이용한 암 치료제 개발 등 다양한 신약 연구 개발을 했다. 그는 현재 비엘의 신약개발(BD)을 총괄하고 있다.
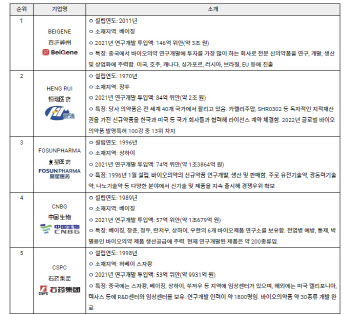
- 바이오 시장 빗장 여는 중국…'K-바이오' 수혜받나
- [이데일리 김승권 기자] 반도체와 배터리에 이어 바이오 분야에서도 미국과 중국의 패권 전쟁이 격화되는 모양새다. 이에 중국이 그간 꽁꽁 닫았던 바이오 내수시장을 외국 제약·바이오기업에게 열어주려는 움직임을 보이고 있다. 중국 정부는 최근 자국에 진출한 외국 제약·바이오기업을 불러 모아 협력을 다짐했다. 이에 국내 제약·바이오기업의 중국 시장 공략법 마련이 시급하다는 분석이다.중국 바이오 의약품 시장 전망 (자료=프로스트앤설리반, 미래에셋대우 리서치 센터)◇ 중국, 수출제한기술목록 개정 등 추진2일 제약바이오업계에 따르면 중국 바이오 정책을 담당하는 왕원타오 상무부장은 지난달 외자기업 원탁회의를 열고 GE헬스케어, 노보노디스크, 바이엘, 머크(MSD), 다케다 등 다국적 제약·바이오기업과 상호 협력을 논의했다. 자국 기업 위주 규제 완화를 적용하던 중국의 태도가 바뀐 것이다. 상무부는 대외무역법과 기술수출입관리규정 등에 따라 중국의 수출제한기술목록 개정도 추진 중이다.현지 증권사의 해외협력부 관계자는 “올해부터 중국 제약사에게서 협업 가능한 기업 발굴에 대한 요청을 많이 받고 있다”며 “분야는 중대 질병 의약품을 포함한 제약·바이오산업 전반”이라고 밝혔다. 중국 바이오의약품시장은 미국에 이은 세계 2위 시장 규모를 갖추고 있다. 미래에셋대우의 리서치 자료에 따르면 중국 바이오의약품 시장 규모는 약 2578억위안(약 43조4000억원, 2018년 기준)으로 오는 2030년까지 연평균 14.4%로 성장할 전망이다. 이는 글로벌 바이오의약품 시장의 성장률인 10%를 웃돈다.하지만 중국의 바이오기술 성과는 아직 미미하다. 중국은 2015년 이후로 바이오기술에 대규모로 투자해왔다. 벤처캐피털, 사모펀드 같은 투자기관이 2015년 이후로 중국 바이오기술 산업에 1조5000억위안(약 285조6000억원) 이상의 자금을 쏟아부었다. 그럼에도 2011~2015년 전 세계에서 승인된 항체 신약 42개 중 중국에서 시판된 약은 4개에 불과했다. 2016년 전 세계에서 승인받은 항체신약 79개 중 중국산은 6개에 그쳤다. 그 결과 암과 같이 신약의 효과가 크게 나타나는 질환에 대해 중국 국민이 혜택을 볼 수 없었다. 대표적 예로 2014년 암 5년 생존율이 미국은 66%이지만 중국은 절반에도 못미치는 30% 수준에 불과하다. 중국 정부가 자국 진출한 바이오기업과 협력을 도모하는 이유가 바로 이것이다. 중국이 지난해 발표한 바이오경제 발전 계획에는 2035년까지 글로벌 선도 기업을 육성한다는 내용이 담겼다. 지난해 중국에서 시판 승인을 받은 신약 총 65개 중 바이오의약품은 19개(신약 6개, 개량신약 13개) 정도다. 중국은 이를 더 늘린다는 방침이다. ◇中 진출한 韓제약·바이오 기업은? 보건산업진흥원은 이런 이유로 최근 해외 제약·바이오기업의 중국 진출이 쉬워졌다고 평가했다. 중국 정부는 의약품 규제기관(CFDA) 혁신을 통해 의약품의 허가 기간을 단축시켜 신약 개발 유인을 제공할 방침이다. 심사 약품, 약품심사평가센터(CDE) 인원 확충 및 지위 격상, 해외 임상 데이터 수용 등이 대표적 사례다. 중국은 2015년 이전과 비교했을 때 임상 및 신약 심사 기간은 약 3분의 1가량 단축됐다. CDE의 우선심사대상으로 지정 받을 경우 일반적 허가 검토 기간은 약 9개월로 과거 2~3년 걸렸던 것과 비교하면 상당 부분 기간이 단축됐다.김지영 보건산업진흥원 책임연구원은 “중국 정부는 ICH 가입 및 인허가 등 일련의 제도 개선 등을 통해 의약품 제조업체 개발 환경 및 유통구조를 개선했다”며 “또한 중국 기업들과 해외 기업간의 합작회사, 라이선스 인/아웃, 인수합병(M&A) 적극 참여 등도 장려했다”고 설명했다. 국가별 1인당 헬스케어 지출액 (자료=세계은행, 미래에셋대우 리서치 센터)◇북경한미약품 中과 합작법인 설립현재 중국에 공장이나 법인이 있거나 수출을 준비하고 있는 기업은 △동아제약·동아에스티 △한미약품 △현대바이오 △GC녹십자 △HK이노엔 △아미코젠 △엘앤씨바이오 △지노믹트리 △LG화학 △휴메딕스 △휴젤 △메디톡스 △제테마 등이다. 먼저 동아제약은 중국에 파티온-노스카나인, 비타그란 등을 판매하고 있고 동에에스티는 항결핵제 크로세린, 병박카스를 수출하고 있다. 북경한미약품은 중국과 합작 법인을 설립한 대표적인 국내 제약사다. 1996년 현지 기업 ‘베이징자죽약업’과 합작, 북경한미약품유한공사를 설립했다. 1997년 주력제품인 어린이 정장제 ‘마미아이’ 생산을 시작으로 감기약 이탄징, 이안핑, 부루펀, 소화제 나얼핑, 고혈압 치료복합제 아모잘탄 등을 판매하고 있다. 중국 진출 한국 제약바이오 기업 (자료=한국보건산업진흥원)GC녹십자는 지주회사 ‘GCHK’와 ‘녹십자생물제품유한공사’, ‘안휘거린커약품판매유한공사’ 3개 법인을 운영하고 있다. GCHK가 중국사업을 총괄하고 있다. GCHK는 2020년 9월 헌터증후군 치료제 ‘헌터라제’의 시판 허가를 획득했고 약가 협상 진행 중이다. HK이노엔의 위식도역류질환 치료제 케이캡도 올해 5월부터 중국 현지 파트너사 뤄신을 통해 세계 1위 소화성 궤양용제 시장인 중국에 진출했다. 동아에스티 관계자는 “글로벌 신약으로 도약하는 리딩 컴퍼니로 거듭나고자 중국에서 전문의약품 수출 확대 및 포트폴리오를 확장해 나갈 계획”이라고 말했다.중국 5대 바이오 기업 (사진=코트라)